
 C(g)�ֱ������ֲ�ͬʵ�������½���,���ǵ���ʼŨ�Ⱦ�Ϊc(A)=" 0.100" mol��L��1 c(B)="0.200" mol��L��1c(C)="0" mol��L��1����Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ������˵����ȷ����
C(g)�ֱ������ֲ�ͬʵ�������½���,���ǵ���ʼŨ�Ⱦ�Ϊc(A)=" 0.100" mol��L��1 c(B)="0.200" mol��L��1c(C)="0" mol��L��1����Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ������˵����ȷ����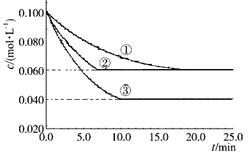
 C(g)�Ħ�H >0
C(g)�Ħ�H >0  C(g)
C(g)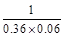 ��
�� C(g)
C(g) ��
��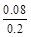 ��100%=40%��C����
��100%=40%��C����


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
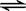 2SO3,��ƽ��ʱSO3Ϊn mol����ͬ�¶��·ֱ��������,ƽ���SO3�����ʵ�������n mol���ǣ� ��
2SO3,��ƽ��ʱSO3Ϊn mol����ͬ�¶��·ֱ��������,ƽ���SO3�����ʵ�������n mol���ǣ� ��| A��2mol SO2��1mol O2 | B��2mol SO2��1mol O2��2mol SO3 |
| C��4mol SO2��1mol O2 | D��3mol SO2��0.5mol O2��1mol SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
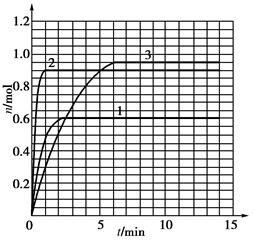
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)(����ӦΪ���ȷ�Ӧ)��Ϊ��ʹƽ�������ɰ��ķ����ƶ����ɲ��õķ�����
2NH3(g)(����ӦΪ���ȷ�Ӧ)��Ϊ��ʹƽ�������ɰ��ķ����ƶ����ɲ��õķ�����| A������ѹǿ | B����Сѹǿ | C�������¶� | D��ʹ�ô��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 PCl3(g)��Cl2(g)
PCl3(g)��Cl2(g)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
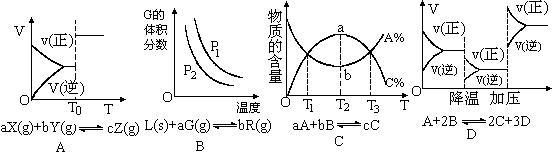
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����κ������£���ѧƽ�ⳣ������һ����ֵ |
| B�����ı䷴Ӧ���Ũ��ʱ����ѧƽ�ⳣ���ᷢ���ı� |
| C����ѧƽ�ⳣ��Kֻ���¶ȡ���Ӧ��Ũ�ȡ���ϵ��ѹǿ���й� |
| D����ѧƽ�ⳣ��K�����ƶ�һ�����淴Ӧ���еij̶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
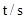 | 0 | 500 | 1000 |
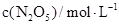 | 5.00 | 3.52 | 2.48 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com