
惰性电极电解饱和食盐水,当溶液中有1mol NaOH生成时,则下列说法不正确的是
A.阴极析出氢气
B.标准状况下,阴极产生的气体为11.2L
C.阳极的电极反应式:2H2O + 2e- = 2OH-+ H2↑
D.电路中有1mol电子通过
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:阅读理解
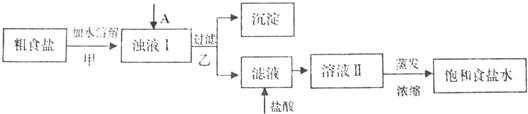
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
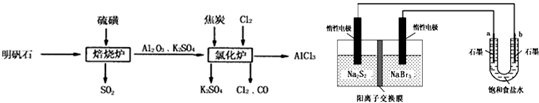
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?丰台区一模)(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.
(2012?丰台区一模)(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.| 假设 | 主要操作 | 现象 | 结论 |
| 假设1: | |||
| 假设2:可能是H+与OH-中和,导致溶液褪色 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com