
【题目】中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料转化成葡萄糖内酯并获得能量。下列说法正确的是( )
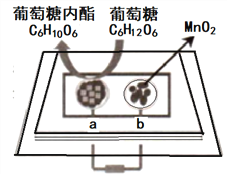
A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. b极的电极反成为:MnO2+2H2O+2e-=Mn2++4OH-
D. 当消耗0.01mol葡萄糖时,电路中转移0.02mol电子
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列有关说法正确的是
A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4 NA
B.4.48L氨气分子中含0.6NA个N-H键
C.铁、Cu片、稀硫酸组成的原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
D.4℃时,20g2H216O中含有共用电子对数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
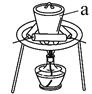
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
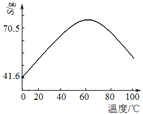
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是 ( )
A. CH4 + Cl2![]() CH3Cl + HCl
CH3Cl + HCl
B. 2CH3CH3+5O2![]() 2CO2+6H2O
2CO2+6H2O
C. ![]()
D. 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。请回答:
(1)甲烷的电子式为 ______________,空间构型为_____________。
(2)下列可以鉴别甲烷和乙烯的试剂为________(填选项字母)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)写出下列化学方程式,并指出反应类型:
CH4与Cl2光照生成CH3Cl_____________________________,反应类型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫、二氧化碳、三氧化硫同时具备的性质是( )
A.都能使品红试液褪色
B.都能和氢氧化钠溶液反应生成盐和水
C.都有刺激性气味
D.常温下都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学过程的化学用语书写正确的是
A. BaSO4投入水中后建立的沉淀溶解平衡:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O![]() 2Al(OH)3↓
2Al(OH)3↓
C. HCO3-的电离:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Na2SO3的水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
【答案】C
【解析】选项A的平衡应该标注各物质的状态,即为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),选项A错误。选项B的电荷不守恒,应该为A13++3A1O2-+6H2O
Ba2+(aq)+SO42-(aq),选项A错误。选项B的电荷不守恒,应该为A13++3A1O2-+6H2O![]() 4Al(OH)3↓,选项B错误。将选项C的方程式两边各去掉一个水分子,即得到:HCO3-
4Al(OH)3↓,选项B错误。将选项C的方程式两边各去掉一个水分子,即得到:HCO3-![]() CO32-+H+,表示的是碳酸氢根的电离,选项C正确。亚硫酸根离子的水解应该分步进行,选项D错误。
CO32-+H+,表示的是碳酸氢根的电离,选项C正确。亚硫酸根离子的水解应该分步进行,选项D错误。
【题型】单选题
【结束】
17
【题目】下列生活中的化学现象解释不正确的是
A. 生石灰可作食品速热剂是利用原电池原理
B. 泡沫灭火器是运用双水解原理产生CO2
C. 铝盐可作净水剂是利用铝离子水解产生胶体
D. 将煤气中毒的人移到通风处,是运用平衡理论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如下,其总反应为 2CH3OH+3O2===2CO2+4H2O。下列说法不正确的是( )

A. 电极 A 是负极,物质 a 为甲醇
B. 电池工作时,电解液中的 H+通过质子交换膜向 B 电极迁移
C. 放电前后电解质溶液的 pH 增大
D. b 物质在电极上发生的电极反应式为: O2+4eˉ+2H2O=4OHˉ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com