
 、
、 .
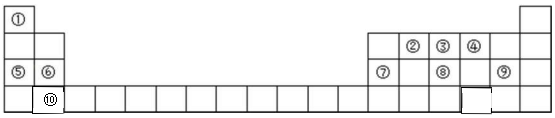
.分析 由元素为周期表的位置可知,①-⑩分别为H、C、N、O、Na、Mg、Al、P、Cl、Ca,
(1)电子层越多,原子半径越大;
(2)非金属性越强,对应最高价含氧酸的酸性越强;
(3)氯气与水反应生成盐酸和次氯酸;
(4)①、④元素组成的化合物为H2O或H2O2;
(5)具有相同电子排布的离子中,原子序数大的离子半径小;
(6)铵盐与碱共热制备氨气.
解答 解:由元素为周期表的位置可知,①-⑩分别为H、C、N、O、Na、Mg、Al、P、Cl、Ca,
(1)电子层越多,原子半径越大,则在这 10 种元素中,原子半径最大的是Ca,故答案为:Ca;
(2)非金属性越强,对应最高价含氧酸的酸性越强,⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是HClO4>H3PO4,
故答案为:HClO4;H3PO4;
(3)氯气与水反应生成盐酸和次氯酸,反应为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
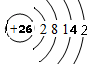
(4)①、④元素组成的化合物为H2O或H2O2,电子式分别为 、
、 ,故答案为:
,故答案为: ;
; ;
;
(5)具有相同电子排布的离子中,原子序数大的离子半径小,则④⑤⑥⑦对应的离子半径最小的是Al3+,故答案为:Al3+;
(6)实验室制取③的气态氢化物的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 元素 | 原子结构或性质 |
| A | 其形成的一种同位素元素在考古中可推测化石的年代 |
| B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
| C | 地壳中含量最多的元素 |
| D | D原子的最外层电子数与其电子层数相同,是地壳中含量最多的金属元素 |
| E | 其单质主要存在于火山口附近 |
| F | 生活中常见的金属,它的某种氧化物均有磁性 |
| G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
 ;
; ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相 关 信 息 |
| A | 原子核外有7种运动状态不同的电子 |
| B | 外围电子排布式为nsnnpn+2 |
| C | 常见的金属,在周期表中周期序数与族序数相等 |
| D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
| E | 一种核素的质量数为56,中子数为30 |
| F | 单质紫红色,电缆材料,常见氧化物为黑色 |
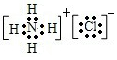
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?CO32-+H3O+ | B. | HCO3-+OH-?CO32-+H2O | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
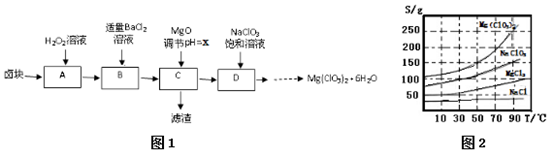
| 化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O | 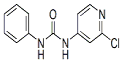 | 白色结晶粉末 | 170~172°C | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com