
·ÖĪö £Ø1£©ŌŚĖ®ČÜŅŗ»ņÕßČŪȌדĢ¬Äܹ»µ¼µēµÄ»ÆŗĻĪļĪŖµē½āÖŹ£¬µē½āÖŹ±ŲŠėŹĒ»ÆŗĻĪļ£»
£Ø2£©H++OH-ØTH2O£¬±ķŹ¾æÉČÜŠŌĒæĖį»ņÕßĒæĖįµÄĖįŹ½ŃĪÓėæÉČÜŠŌĒæ¼ī·“Ӧɜ³ÉæÉČÜŠŌŃĪŗĶĖ®£»
£Ø3£©ĮņĖįĀĮĪŖĒæµē½āÖŹ£¬µēĄėÉś³ÉĀĮĄė×ÓŗĶĮņĖįøłĄė×Ó£»øł¾Ż¹«Ź½N=nNA=$\frac{m}{M}$NAŅŌ¼°c=$\frac{n}{V}$Ą“¼ĘĖć½ā“š£»
£Ø4£©ÉŁĮæµÄ¶žŃõ»ÆĢ¼æÉŅŌŗĶĒæ¼ī·“Ӧɜ³ÉĢ¼ĖįŃĪŗĶĖ®£»
£Ø5£©ĒāŃõ»Æ±µÓėĮņĖįĒāÄĘ°“ÕÕĪļÖŹµÄĮæÖ®±Č1£ŗ1·“Ó¦£¬ĮņĖįøłĄė×ÓĒ”ŗĆ³ĮµķĶźČ«£®
½ā“š ½ā£ŗ£Ø1£©¢ŁH2 ŹĒµ„ÖŹ²»ŹĒµē½āÖŹ£»
¢ŚĀĮŹĒµ„ÖŹ²»ŹĒµē½āÖŹ£»
¢ŪCaOČŪȌדĢ¬ĻĀÄܵ¼µē£¬ŹōÓŚµē½āÖŹ£»
¢ÜCO2 ±¾Éķ²»ÄܵēĄė²śÉś×ŌÓÉŅĘ¶ÆĄė×Ó£¬ŹĒ·Ēµē½āÖŹ£»
¢ŻNaHSO4 ŌŚĖ®ČÜŅŗ»ņÕßČŪȌדĢ¬Äܹ»µ¼µēµÄ»ÆŗĻĪļĪŖµē½āÖŹ£»
¢ŽBa£ØOH£©2ŌŚĖ®ČÜŅŗ»ņÕßČŪȌדĢ¬Äܹ»µ¼µēµÄ»ÆŗĻĪļĪŖµē½āÖŹ£»
¢ßĒāŃõ»ÆĢś½ŗĢåŹĒ»ģŗĻĪļ£¬²»ŹĒµē½āÖŹ£»
¢ą°±Ė® ŹĒ»ģŗĻĪļ£¬²»ŹĒµē½āÖŹ£»
¢įĻ”ĻõĖįŹĒ»ģŗĻĪļ£¬²»ŹĒµē½āÖŹ£»
Ėį¢āAl2£ØSO4£©3ŌŚĖ®ČÜŅŗ»ņÕßČŪȌדĢ¬Äܹ»µ¼µēµÄ»ÆŗĻĪļĪŖµē½āÖŹ£»
ĖłŅŌŹōÓŚµē½āÖŹµÄŹĒ¢Ū¢Ż¢Ž¢ā£»
¹Ź“š°øĪŖ£ŗ¢Ū¢Ż¢Ž¢ā£»
£Ø2£©H++OH-ØTH2O£¬±ķŹ¾æÉČÜŠŌĒæĖį»ņÕßĒæĖįµÄĖįŹ½ŃĪÓėæÉČÜŠŌĒæ¼ī·“Ӧɜ³ÉæÉČÜŠŌŃĪŗĶĖ®£¬æÉŅŌ±ķŹ¾ĒāŃõ»Æ±µÓėĻõĖįµÄ·“Ó¦£¬·½³ĢŹ½£ŗBa£ØOH£©2+2HNO3ØTBa£ØNO3£©2+2H2O£»
¹Ź“š°øĪŖ£ŗBa£ØOH£©2+2HNO3ØTBa£ØNO3£©2+2H2O£»
£Ø3£©ĮņĖįĀĮŹĒĒæµē½āÖŹ£¬ÄÜĶźČ«µēĄė£¬µēĄė·½³ĢŹ½ĪŖ£ŗAl2£ØSO4£©3=2Al3++3SO42-£¬17.1gAl2£ØSO4£©3ČÜÓŚĖ®Åä³É250mLČÜŅŗ£¬SO42-µÄĮ£×ÓŹżĪŖ$\frac{17.1g}{342g/mol}$=9.03”Į1022£¬SO42-µÄĪļÖŹµÄĮæÅضČc=$\frac{n}{V}$=0.6mol/L£¬ĀĮĄė×ÓĪļÖŹµÄĮæÅضČĪŖ£ŗ$\frac{2}{3}$”Į0.6mol/L=0.4mol/L£»
¹Ź“š°øĪŖ£ŗ9.03”Į1022£¬0.4mol/L£»
£Ø4£©ÉŁĮæµÄ¶žŃõ»ÆĢ¼æÉŅŌŗĶĒæ¼īĒāŃõ»Æ±µ·“Ӧɜ³ÉĢ¼Ėį±µŗĶĖ®£¬¼“Ba£ØOH£©2+CO2=BaCO3”ż+H2O£¬
¹Ź“š°øĪŖ£ŗBa£ØOH£©2+CO2=BaCO3”ż+H2O£»
£Ø5£©ĒāŃõ»Æ±µÓėĮņĖįĒāÄĘ°“ÕÕĪļÖŹµÄĮæÖ®±Č1£ŗ1·“Ó¦£¬ĮņĖįøłĄė×ÓĒ”ŗĆ³ĮµķĶźČ«£¬Ąė×Ó·½³ĢŹ½£ŗH++SO42-+Ba2++OH-ØTBaSO4”ż+H2O£»
¹Ź“š°øĪŖ£ŗH++SO42-+Ba2++OH-ØTBaSO4”ż+H2O£®
µćĘĄ ±¾Ģāæ¼²éĮĖµē½āÖŹÅŠ¶Ļ£¬ĪļÖŹµÄĮæÓŠ¹Ų¼ĘĖć£¬Ąė×Ó·½³ĢŹ½ŹéŠ“£¬Ć÷Č·µē½āÖŹøÅÄī£¬ŹģĻ¤ŅŌĪļÖŹµÄĮæĪŖŗĖŠÄ¼ĘĖć¹«Ź½ŹĒ½āĢā¹Ų¼ü£¬²ąÖŲæ¼²éѧɜ·ÖĪöŗĶ½ā¾öĪŹĢāµÄÄÜĮ¦£¬ÄŃ¶Č²»“ó£®


 æĪæĪÓÅÄÜĮ¦ÅąÓÅ100·ÖĻµĮŠ“š°ø
æĪæĪÓÅÄÜĮ¦ÅąÓÅ100·ÖĻµĮŠ“š°ø ÓÅ°Ł·ÖæĪŹ±»„¶ÆĻµĮŠ“š°ø
ÓÅ°Ł·ÖæĪŹ±»„¶ÆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
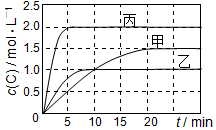 Ļņ¼×”¢ŅŅ”¢±ūČżøöĆܱÕČŻĘ÷ÖŠ³äČėŅ»¶ØĮæµÄAŗĶB£¬·¢Éś·“Ó¦£ŗA£Øg£©+xB£Øg£©?2C£Øg£©£®ø÷ČŻĘ÷µÄ·“Ó¦ĪĀ¶Č”¢·“Ó¦ĪļĘšŹ¼Į棬·“Ó¦¹ż³ĢÖŠCµÄÅضČĖꏱ¼ä±ä»Æ¹ŲĻµ·Ö±šŅŌČē±ķŗĶČēĶ¼±ķŹ¾£ŗ
Ļņ¼×”¢ŅŅ”¢±ūČżøöĆܱÕČŻĘ÷ÖŠ³äČėŅ»¶ØĮæµÄAŗĶB£¬·¢Éś·“Ó¦£ŗA£Øg£©+xB£Øg£©?2C£Øg£©£®ø÷ČŻĘ÷µÄ·“Ó¦ĪĀ¶Č”¢·“Ó¦ĪļĘšŹ¼Į棬·“Ó¦¹ż³ĢÖŠCµÄÅضČĖꏱ¼ä±ä»Æ¹ŲĻµ·Ö±šŅŌČē±ķŗĶČēĶ¼±ķŹ¾£ŗ| ČŻĘ÷ | ¼× | ŅŅ | ±ū |
| ČŻ»ż | 0.5 L | 0.5 L | 1.0 L |
| ĪĀ¶Č/”ę | T1 | T2 | T2 |
| ·“Ó¦Īļ ĘšŹ¼Įæ | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A£® | Ę½ŗāŗó£¬Ļņ¼×ČŻĘ÷ÖŠŌŁ³äČė0.5 mol A£¬AŗĶBµÄ×Ŗ»ÆĀŹ¾łŌö“ó | |
| B£® | “ļµ½Ę½ŗāŹ±·“Ó¦ĪüŹÕµÄČČĮæ£ŗQ±ū£¾2QŅŅ | |
| C£® | ČōĘ½ŗāŹ±±£³ÖĪĀ¶Č²»±ä£¬øıäČŻĘ÷Ģå»żĘ½ŗā²»ŅĘ¶Æ | |
| D£® | T1”ę£¬ĘšŹ¼Ź±¼×ČŻĘ÷ÖŠ³äČė0.5 mol A”¢1.5 mol B£¬Ę½ŗāŹ±AµÄ×Ŗ»ÆĀŹĪŖ25% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ōö“ó·“Ó¦ĪļµÄÅØ¶Č£¬æÉŌö“óµ„Ī»Ģå»żÄŚ»ī»Æ·Ö×ӵİŁ·ÖŹż£¬“Ó¶ųŹ¹ÓŠŠ§Åöײ“ĪŹżŌö“ó | |
| B£® | ÓŠĘųĢå²Ī¼ÓµÄ»Æѧ·“Ó¦£¬ČōŌö“óŃ¹Ēæ£Ø¼“ĖõŠ”·“ӦȯĘ÷µÄĢå»ż£©£¬æÉŌö¼Ó»ī»Æ·Ö×ӵİŁ·ÖŹż£¬“Ó¶ųŹ¹·“Ó¦ĖŁĀŹŌö“ó | |
| C£® | ÉżøßĪĀ¶ČÄÜŹ¹»Æѧ·“Ó¦ĖŁĀŹŌö“ó£¬Ö÷ŅŖŌŅņŹĒŌö¼ÓĮĖ·“Ó¦Īļ·Ö×ÓÖŠ»ī»Æ·Ö×ӵİŁ·ÖŹż | |
| D£® | “߻ƼĮĖäČ»²»²Ī¼Ó»Æѧ·“Ó¦£¬µ«ÄÜŌö“óµ„Ī»Ģå»żÄŚ»ī»Æ·Ö×ӵďżÄ棬“Ó¶ųŌö“ó·“Ó¦ĖŁĀŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ijČÜŅŗÖŠµĪ¼ÓAgNO3ČÜŅŗÓŠ°×É«³Įµķ£¬ĖµĆ÷ŌČÜŅŗÖŠÓŠCl- | |
| B£® | ijČÜŅŗÖŠĻȵĪ×ćĮæŃĪĖįĪŽĻÖĻó£¬ŌŁµĪ¼ÓBaCl2ČÜŅŗÓŠ°×É«³Įµķ£¬ĖµĆ÷ŌČÜŅŗÖŠÓŠSO42- | |
| C£® | ijČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗÓŠĄ¶É«³Įµķ£¬ĖµĆ÷ŌČÜŅŗÖŠÓŠFe3+ | |
| D£® | ijČÜŅŗÖŠµĪ¼ÓĻ”ĮņĖįÉś³ÉĪŽÉ«ĘųĢ壬ĖµĆ÷ŌČÜŅŗÖŠÓŠCO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 CO2ŹĒŅ»ÖÖĪĀŹŅĘųĢ壬¾ŻæĘѧ¼ŅŌ¤²ā£¬µ½21ŹĄ¼ĶÖŠŅ¶£¬Č«ĒņĘųĪĀ½«Éżøß1.5-4.5”ę£¬µŲĒņĘųĪĀµÄÉżøß»įŅżĘšŗ£Ę½ĆęÉżøߣ¬¶ŌČĖĄąµÄÉś“ę»·¾³²śÉś¾Ž“óµÄÓ°Ļģ£®ČēŗĪŗĻĄķµŲĄūÓĆCO2ŹĒ°ŚŌŚæĘѧ¼ŅĆęĒ°µÄŅ»øöÖŲ“óæĪĢā£®»Ų“šĻĀĮŠĪŹĢā£ŗ
CO2ŹĒŅ»ÖÖĪĀŹŅĘųĢ壬¾ŻæĘѧ¼ŅŌ¤²ā£¬µ½21ŹĄ¼ĶÖŠŅ¶£¬Č«ĒņĘųĪĀ½«Éżøß1.5-4.5”ę£¬µŲĒņĘųĪĀµÄÉżøß»įŅżĘšŗ£Ę½ĆęÉżøߣ¬¶ŌČĖĄąµÄÉś“ę»·¾³²śÉś¾Ž“óµÄÓ°Ļģ£®ČēŗĪŗĻĄķµŲĄūÓĆCO2ŹĒ°ŚŌŚæĘѧ¼ŅĆęĒ°µÄŅ»øöÖŲ“óæĪĢā£®»Ų“šĻĀĮŠĪŹĢā£ŗ| CO2µÄĮæ | NaOHČÜŅŗµÄĮæ | ·Å³öµÄČČĮæ | |
| ¢Ł | 22.0g | 750mL1.0mol•L-1 | xkJ |
| ¢Ś | 1.0mol | 2.0mL1.0mol•L-1 | ykJ |
| ĪļÖŹ | CO2£Øg£© | H2£Øg£© | CH4£Øg£© | H2O£Øg£© |
| ÅضČ/mol•L-1 | 0.2 | 0.8 | a | 1.6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Äų¾ßÓŠÓÅĮ¼µÄĪļĄķŗĶ»ÆѧĢŲŠŌ£¬ŹĒŠķ¶ąĮģÓņÓČĘäŹĒøß¼¼Źõ²śŅµµÄÖŲŅŖŌĮĻ£®ōŹ»ł·ØĢį“æ“ÖÄųÉę¼°µÄĮ½²½·“Ó¦ŅĄ“ĪĪŖ£ŗ
Äų¾ßÓŠÓÅĮ¼µÄĪļĄķŗĶ»ÆѧĢŲŠŌ£¬ŹĒŠķ¶ąĮģÓņÓČĘäŹĒøß¼¼Źõ²śŅµµÄÖŲŅŖŌĮĻ£®ōŹ»ł·ØĢį“æ“ÖÄųÉę¼°µÄĮ½²½·“Ó¦ŅĄ“ĪĪŖ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÅØĮņĖįĻ”ŹĶŹ±Ó¦×¢Ņā½«ÅØĮņĖį»ŗ»ŗµŲµ¹ČėŹ¢ÓŠĖ®µÄČŻĮæĘæÖŠ | |
| B£® | ½«11.2L HClČÜÓŚĖ®ŠĪ³É1LČÜŅŗ£¬ĖłµĆČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ0.5mol/L | |
| C£® | 0.5mol/LµÄNa2SO4ŗĶ1mol/LµÄNaOHČÜŅŗ£¬c£ØNa+£©ĻąĶ¬ | |
| D£® | ½«20g NaOH ČÜÓŚ1LĖ®ÖŠ¼“µĆµ½0.5mol/LµÄNaOHČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com