【答案】
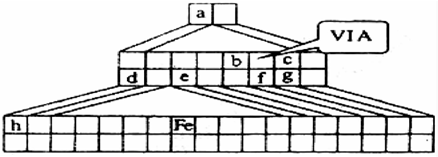
分析:金字塔式元素周期表的实质是将原周期表的空隙部分进行了删除形成的,与原元素周期表没有本质的区别,第一行为第一周期元素,第二行为第二周期元素,依此类推,同行自左而右顺序与原周期表相同.
(1)最外层电子数小于或等于其周期数的为金属元素,据此描出金属与非金属的分界线;铁元素在第四周期第8列,为第Ⅷ族,包括8、9、10三列;
(2)第ⅦA族的元素的最低化合价为-1价,则LiH为离子化合物;
(3)由元素周期表可知,f为S元素,c为F元素,g为Cl元素.f与c能形成化合物SF
6,f能与g形成化合物S
2Cl;
①根据S的化合价及F的非金属最强回答;
②f
2g
2是S
2Cl
2晶体,根据8电子稳定结构书写结构式;根据现象判断产物,配平写出方程式;
(4)a为H元素,f为S元素,a和f形成化合物H
2S,杂化轨道数=孤对电子对+δ键数,S原子成2个δ键,还有2对孤对电子对;
(5)根据元素所在周期表中的位置,结合元素周期律的有关递变规律以及对应元素化合物的性质解答该题.
解答:解:(1)金字塔式元素周期表的实质是将原周期表的空隙部分进行了删除形成的,与原元素周期表没有本质的区别,第一行为第一周期元素,第二行为第二周期元素,依此类推,同行自左而右顺序与原周期表相同.
最外层电子数小于或等于其周期数的为金属元素,据此描出金属与非金属的分界线;
铁元素在第四周期第8列,为第Ⅷ族,包括8、9、10三列.
故答案为:

;
(2)第ⅦA族的元素的最低化合价为-1价,则LiH为离子化合物,电子式为Li
+[:H]
-,故答案为:Li
+[:H]
-;
(3)①SF
6中S元素显+6价不可再升,氧气不能将-1价氟氧化,故答案为:SF
6中S元素显+6价不可再升,氧气不能将-1价氟氧化;
②f
2g
2是S
2Cl
2晶体,S原子成2个共价键达8电子稳定结构,Cl原子成1个共价键达8电子稳定结构,结构式为

,
该物质遇水不稳定,生成一种黄色沉淀为S单质,生成无色气体为SO
2,还得到一种酸性溶液为HCl,反应方程式为
2S
2Cl
2+2H
2O=3S+SO
2↑+4HCl,
故答案为:

;2S
2Cl
2+2H
2O=3S+SO
2↑+4HCl;
(4)a和f形成化合物H
2S,S原子成2个δ键,还有2对孤对电子对,杂化轨道数=孤对电子对+δ键数=2+2=4,所以S原子采取sp
3杂化,H
2S分子空间构型为V型,
故答案为:sp
3;V型;
(5)A.h是K元素,金属性很强,其最高价氧化物对应的水化物KOH是强碱,故A正确;
B.f是S元素,非金属性比硒强,硒化氢不如硫化氢稳定,故B错误;
C.c是F元素,h是K元素,形成的盐为强碱弱酸盐,其水溶液显碱性,故C错误;
D.f是S元素,h是K元素,d是Na元素,g是Cl元素,核外电子排布相同核电荷数越大半径越小,所以f>g>h,最外层电子数相同,电子层越大半径越大,所以h>d,所以离子半径:f>g>h>d,故D正确;
E.f是S元素,d是Na元素,二者形成化合物是离子化合物,属于电解质,晶体无自由移动的离子,不能导电,故E错误;
F.a为H元素,d是Na元素,E是Al元素,对应常见氧化物为水、氧化钠、氧化铝,分别为分子晶体、离子晶体、原子晶体,所以氧化物熔沸点水<氧化钠<氧化铝,故F正确.
故选:ADF.
点评:本题考查位置结构性质的相互关系及应用,题目难度不大,注意把握元素周期律的主要内容,本题关键在于理解金字塔式元素周期表,与原元素周期表没有本质的区别.

 ;
; ,
, ;2S2Cl2+2H2O=3S+SO2↑+4HCl;
;2S2Cl2+2H2O=3S+SO2↑+4HCl;

 名校课堂系列答案
名校课堂系列答案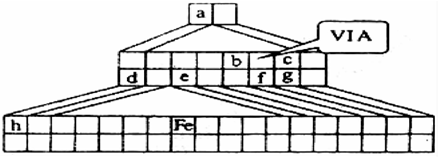


 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )