
| A. | 增加C的量 | |
| B. | 加催化剂 | |
| C. | 保持体积不变,充入氮气使体系压强增大 | |
| D. | 保持压强不变,充入氮气使容器体积增大 |
分析 A.碳是固体,碳量的多少不影响平衡移动;
B.催化剂只改变化学反应速率,不影响平衡移动;
C.保持体积不变,充入氮气使体系压强增大,但反应物和生成物浓度都不变;
D.保持压强不变,充入氮气使容器体积增大,但反应物和生成物分压减小,相当于减小压强.
解答 解:A.碳是固体,碳量的多少不影响平衡移动,所以增加C的量平衡不移动,故A错误;
B.催化剂只改变化学反应速率,不影响平衡移动,所以加入催化剂不影响平衡移动,故B错误;
C.保持体积不变,充入氮气使体系压强增大,但反应物和生成物浓度都不变,则平衡不移动,故C错误;
D.保持压强不变,充入氮气使容器体积增大,但反应物和生成物分压减小,相当于减小压强,减小压强平衡向气体体积增大的方向正反应方向移动,故D正确;
故选D.
点评 本题考查化学平衡移动影响原理,为高频考点,明确温度、浓度、压强对化学平衡影响原理是解本题关键,注意CD的区别,侧重考查学生分析判断能力,题目难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:多选题
| A. | 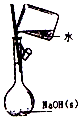 配制0.10mol/L NaOH溶液 | |
| B. | 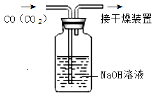 除去CO中的CO2 | |
| C. | 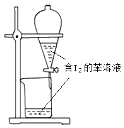 苯萃取碘水中的I2分出水层后的操作 | |
| D. | 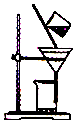 除去粗盐溶液中的不溶物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
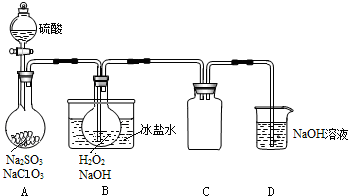
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
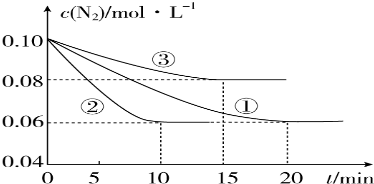
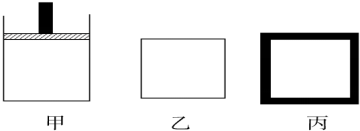
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温、低压 | B. | 适宜的温度、高压、催化剂 | ||
| C. | 低温、低压 | D. | 低温、高压、催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
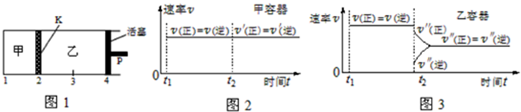
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
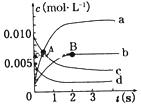 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO) 随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO) 随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在我国上海举办的世博会采取了许多节能环保措施,充分利用太阳能是其中之一 | |
| B. | 氧化铝陶瓷是一种超硬物质,能抵抗冷热冲击,是一种高压钠灯灯管的良好材料 | |
| C. | 空气污染指数的项目包括:二氧化硫、二氧化氮和可吸入颗粒物等 | |
| D. | 为了防止食物腐败,可以向食品中加入大量的NaNO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com