
| A. | 乙醇的沸点高于乙醛是因为乙醇分子间存在氢键,而乙醛分子间只有范德华力 | |
| B. | 单质碘易溶于CCl4而微溶于水,是因为I2和CCl4都是非极性分子而水是极性分子 | |
| C. | NH3与CH4的空间构型不同是因为NH3中存在孤电子对而CH4中只有成键电子对 | |
| D. | 水分子比硫化氢稳定是因为水分子存在氢键 |
分析 A.乙醇分子间可形成氢键导致沸点较高;
B.一般说来,极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂;
C.CH4的中心原子没有孤电子对,其键角为109°28′,NH3的中心原子含有1个孤电子对,键角为107°18′;
D.分子稳定性与化学键有关,与氢键无关.
解答 解:A.乙醇分子间存在氢键,乙醛分子间不能形成氢键,所以乙醇的沸点比乙醛高,故A正确;
B.碘、CCl4是非极性分子,水是极性分子,根据物质溶解性“相似相溶”的一般规律,因此碘不易溶于水,易溶于CCl4,故B正确;
C.孤电子对与成键电子对间的斥力大于成键电子对间的斥力,CH4的中心原子没有孤电子对,其键角为109°28′,NH3的中心原子含有1个孤电子对,键角为107°18′,故C正确;
D.H2O分子比H2S分子稳定,是因H-O键能比H-S键能大,与氢键无关,故D错误;
故选D.
点评 本题考查了氢键、分子空间构型等知识,侧重氢键知识的综合应用考查,注意氢键不是化学键,分子稳定性与化学键有关,与氢键无关,为易错点,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | N2的电子式: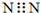 | ||
| C. | 硫离子结构示意图: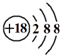 | D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ⑨ |
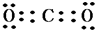 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程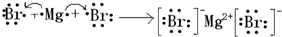
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
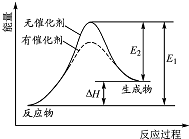 某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )| A. | 催化剂能改变该反应的焓变 | B. | 催化剂能降低该反应的活化能 | ||
| C. | 该反应为放热反应 | D. | E1 越大,表明该反应越容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.06mol/(L•min) | B. | 0.075mol/(L•min) | C. | 0.09mol/(L•min) | D. | 0.12mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | NaHSO4?Na ++HSO4- | ||
| C. | NaHCO3?Na++H++CO32- | D. | HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| B. | 焰色反应为金属元素的物理性质 | |
| C. | 镁铝合金可用作制造飞机的材料 | |
| D. | 高纯硅用来制造光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com