
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下性质稳定,加热至560 ℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
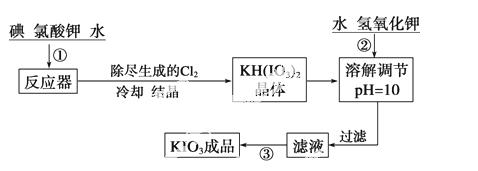
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6∶11,则反应器中发生反应的化学方程式为
_____________________________________________________________________。
(2)步骤②中调节pH=10的目的是_______________________________________。
参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100 g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
操作③的方法是_____________________________________________________。
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有_______________________________________________________________________。
学生乙对纯净的NaCl进行了如下实验:取1 g纯净的NaCl,加3 mL水配成溶液,然后滴入5滴淀粉溶液和1 mL 0.1 mol·L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1 mol·L-1的H2SO4,振荡,一段时间后溶液变浅蓝色。请推测实验中产生蓝色现象的可能原因,用离子方程式表示
______________________________________________________________________。
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇。丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540 ℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:_________________________________________________;
检验沉淀已经洗涤干净的方法是_________________________________________。
科目:高中化学 来源: 题型:
下列关于物质应用和组成的说法正确的是( )
A.P2O5可用于干燥Cl2和NH3
B.“可燃冰”主要成分是甲烷和水
C.CCl4可用于鉴别溴水和碘水
D.Si和SiO2都用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
萤火虫发光前后物质的变化如下:
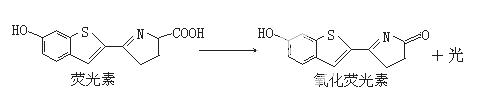
下列关于荧光素和氧化荧光素的叙述不正确的是( )
A. 二者的分子组成相差一个CHO
B.二者的分子组成相差一个CH2O
C.都能使酸性KMnO4溶液褪色
D.都既能发生加成反应又能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
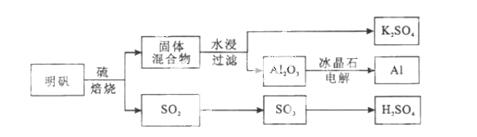
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
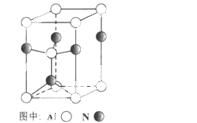
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是 ① 。
焙烧948t明矾(M=474 g/mol ),若SO2 的利用率为96%,可生产质量分数为98%的硫酸 ② t。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO 等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO ,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
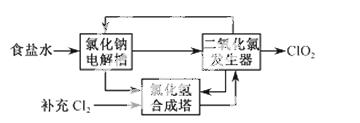
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有____________(填化学式),发生器中生成ClO2的化学方程式为___________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______倍
查看答案和解析>>
科目:高中化学 来源: 题型:
通常情况下,苯的化学性质较稳定,这是由于( )
A.苯不能使酸性KMnO4溶液褪色
B.苯不与溴水发生加成反应
C.是由苯的分子结构所决定的
D.苯是芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃A不能使溴水褪色,0.5 mol A完全燃烧时,得到1.5 mol水和67.2 L二氧化碳(标准状况)。
(1)A的结构简式为________。
(2)根据下列条件写出有关反应的化学方程式:
①在催化剂FeCl3的作用下,A与Cl2反应生成B;
________________________________________________________________________。
②在催化剂作用下A与H2反应生成C。
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
从给定化合价的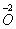 、
、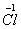 、
、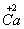 、
、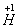 、
、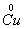 、
、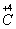 六种元素中,选择适当的元素,按下列要求组成物质(填写化学式)。
六种元素中,选择适当的元素,按下列要求组成物质(填写化学式)。
⑴单质 ___________ ; ⑵氧化物 _________ ;
⑶金属元素和非金属元素组成的化合物 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com