
【题目】某Cu(Ⅱ)盐晶体组成可表示为Ka[Cub(C2O4)c]·dH2O,为测定其组成,实验如下:
(1)溶液的配制
准确称取3.540 g样品,加入1mol·L-1H2SO4溶解,配制成100mL溶液。所需要的玻璃仪器有量筒、烧杯、胶头滴管、____、______。
(2)铜含量的测定
取所配溶液25.00mL于锥形瓶中,加入过量淀粉—KI溶液,充分反应后,生成的I2与12.50mL0.2000mol·L-1Na2S2O3恰好完全反应。已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O32—= 2I-+S4O62—。判断生成的I2与Na2S2O3恰好完全反应的现象为______。3.540 g样品中n(Cu2+)=_____mol。
(3)草酸根含量的测定
取另一份所配溶液25.00mL于锥形瓶中,滴入0.1000 mol·L-1KMnO4溶液至恰好完全反应,消耗20.00 mL KMnO4溶液。已知:2MnO4—+5C2O42—+16H+=2Mn2++8H2O+10CO2↑,所配溶液中c(C2O42—)=____mol·L-1。
(4)计算该铜盐的组成(写出计算过程)____。
【答案】100mL容量瓶 玻璃棒 蓝色褪去 0.01 0.2
K2[Cu(C2O4)2]·2H2O
【解析】
利用信息,先求出铜离子的物质的量,再根据氧化还原反应求出草酸根的物质的量,根据物质的量和化合价写出初步化学式,再根据质量求出水的质量和物质的量,再根据物质的量求出化学式。
某Cu(Ⅱ)盐晶体组成可表示为Ka[Cub(C2O4)c]·dH2O,为测定其组成,实验如下:
⑴准确称取3.540 g样品,加入1mol·L-1H2SO4溶解,配制成100mL溶液。所需要的玻璃仪器有量筒、烧杯、胶头滴管、100mL容量瓶、玻璃棒,
故答案为:100mL容量瓶;玻璃棒;
⑵判断生成的I2与Na2S2O3恰好完全反应的现象为蓝色褪去,

解得x = 2.5×10-3 mol
3.540 g样品中n(Cu2+) = 2.5×10-3 mol ×4 = 0.01mol。
故答案为:蓝色褪去;0.01;
⑶另一份所配溶液25.00mL于锥形瓶中,滴入0.1000 mol·L-1KMnO4溶液至恰好完全反应,消耗20.00 mL KMnO4溶液。已知:
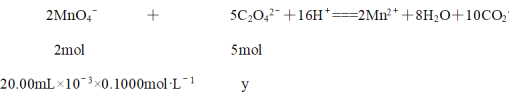
解得y = 5×10-3 mol
所配溶液中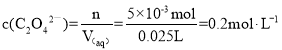
⑷3.540 g样品中n(Cu2+) = 2.5×10-3 mol ×4 = 0.01mol
3.540 g样品中n(C2O42-) = 5×10-3 mol ×4 = 0.02mol
根据上面分析得出n(Cu2+):n(C2O42-) =1:2,再根据化合价得出化学式K2[Cu(C2O4)2],物质的量为0.01 mol,则质量为0.01 mol × 318gmol-1 = 3.18g
m(H2O) = 3.540 g - 3.18 g = 0.360 g, n(H2O) = 0.02 mol
因此化学式为K2[Cu(C2O4)2]·2H2O,
故答案为:K2[Cu(C2O4)2]·2H2O;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,用浓度为![]() 的盐酸分别逐滴加入到
的盐酸分别逐滴加入到![]() 的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是
的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是![]()
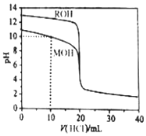
A.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度的关系是:![]()
C.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
D.![]() 时,不可能存在:
时,不可能存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W(分子式C3H6O3)能与NaHCO3反应产生CO2,也能与Na反应生成H2,且1 mol W与足量Na反应能生成1 mol H2,分子中核磁共振氢谱为四组峰,峰面积之比为3∶1∶1∶1。
(1)W的结构简式是______________。
(2)W在不同条件下可脱水形成不同物质。若两分子W反应形成环酯,写出反应方程式:_________________。
(3)W的某种同分异构体具有下列性质:
能发生的银镜反应;1 mol该物质能跟金属钠反应产生1 mol H2。
则该同分异构体的结构简式为____________(已知同一个碳原子上不能连接2个羟基)。
(4)W的工业合成路线如图所示:
乙烯![]() A
A![]() B
B![]() C
C![]() D
D![]()
![]() W
W
已知:Ⅰ.A、B、C、D与W分子中含有相同碳原子数;
Ⅱ.RCH2COOH![]()
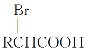
①写出A的名称:__________。
②B与新制Cu(OH)2悬浊液反应的化学方程式是: _______________。
③D与NaOH水溶液反应的化学方程式为:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质![]() 部分条件未标出
部分条件未标出![]() :
:
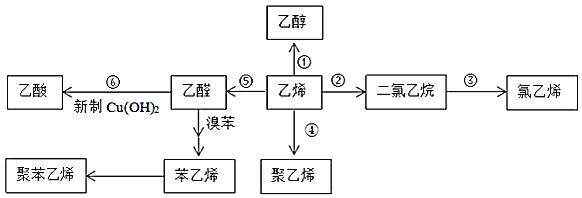
(1)乙醇能与乙酸反应生成有果香味的物质,其名称为______,该反应类型是______;
(2)反应![]() 的化学方程式是______,实验现象是______;
的化学方程式是______,实验现象是______;
(3)反应![]() 用KOH的乙醇溶液处理二氯乙烷制氯乙烯的方程式为:______;
用KOH的乙醇溶液处理二氯乙烷制氯乙烯的方程式为:______;
(4)苯乙烯中所含官能团的名称______;
(5)苯乙烯合成聚苯乙烯的化学方程式是______;
(6)以乙醇和苯乙烯为原料合成有机物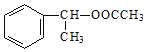 ,写出合成路线图______。
,写出合成路线图______。![]() 合成路线常用的表示方法为:A
合成路线常用的表示方法为:A![]() B目标产物
B目标产物![]() 目标产物
目标产物![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种新型液硫二次电池,其工作原理如图所示。下列说法错误的是

A. 放电时,电池左侧为负极,发生氧化反应
B. 充电时,电解质溶液中K+经交换膜向右侧移动
C. 放电时,电池右侧的电极反应为I3-+2e-=3I-
D. 充电时,电池的总反应为S22-+3I-![]() 2S2-+I3-
2S2-+I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.电解精炼铜时,若转移2NA个电子,则阳极减少的质量为64g
B.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
C.![]() 在常温下能自发进行,则该反应的△H>0
在常温下能自发进行,则该反应的△H>0
D.常温下,![]() 。欲使溶液中
。欲使溶液中![]() ,需调节溶液的
,需调节溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。
(1)氨气属于共价型氢化物,工业常用氨气和醋酸二氨合铜[Cu(NH3)2]Ac的混合液来吸收CO(醋酸根离子简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+CO+NH3=[Cu(NH3)3CO]Ac
①氨水溶液中各元素原子的第一电离能从大到小排列顺序为___________。
②醋酸分子(CH3COOH)中的两个碳原子的杂化方式分别是_________________。
③生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________(填序号)。
A.离子键b.金属键c.共价键d.配位键
(2)某离子化合物XY2,晶胞结构如图所示,其中6个Y原子用数字1~6标注。
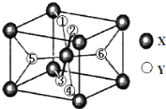
已知1、2、3、4号Y原子在晶胞上、下面上,则5、6号Y原子均在晶胞_________(填“侧面”或“内部”)。
②根据以上信息可以推知,XY2晶体的熔沸点______(填“>”、“=”或“<”)固态氨的熔沸点。
③若该晶胞的边长为anm,密度为ρg/cm3,XY2的摩尔质量为Mg/mol,则阿伏加德罗常数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L。当反应达到平衡时可能存在的数据正确的是
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L。当反应达到平衡时可能存在的数据正确的是
A. c(O2)=0.2mol/LB. c(SO2)=0.25mol/L
C. c(SO2)+c(SO3)=0.3mol/LD. c(SO2)=c(SO3)=0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型二次电池反应原理为M+3Cn(MCl4)+4MC14-![]() 4M2C17-+3Cn(M代表金属,Cn代表石墨)。装置如图所示。下列说法正确的是
4M2C17-+3Cn(M代表金属,Cn代表石墨)。装置如图所示。下列说法正确的是
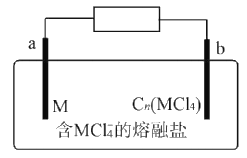
A. 放电时,MCl4-向b极迁移
B. 放电时,a极反应为M-3e-+7MCl4-=4M2Cl7-
C. 充电时,阳极反应式为Cn+MCl4-+e-=Cn(MCl4)
D. 电路上每转移lmol电子最多有3 mol Cn(MCl4)被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com