
【题目】下列物质在水溶液中的电离方程式书写错误的是( )
A. NaHCO3===Na++H++![]()
B. NH4NO3===![]() +
+![]()
C. NaHSO4===Na++H++![]()
D. Ba(OH)2===Ba2++2OH﹣
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式_______________________________________。
(2)该反应的△H__________0。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正_______(填<、>或=,下同)υ逆。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中________点,比较图中B、D两点所对应的正反应速率υB_________υD,理由是___________。D点温度高于B点,温度越高反应速率越大,所以反应速率也大于B

(4)一定条件下要提高反应物的转化率,可以采用的措施是___________。
a.升高温度 b.加入催化剂
c.压缩容器的体积 d.增加水蒸气的浓度 e.及时分离出产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分为Al2O3、Fe2O3和SiO2,工业上经过如图所示工艺可以冶炼金属铝。下列说法中不正确的是
![]()
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ④进行的操作是过滤、加热,而且d一定是氧化铝
D. ③中需要通入过量的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的甲烷和氨气相比较,下列结论中错误的是( )
A.两种气体的分子个数之比为17∶16
B.同温同压下,两种气体的体积之比为17∶16
C.两种气体的氢原子个数之比为17∶12
D.同温同压下,两种气体的密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O![]() 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
实验 编号 | 初始 pH | 废水样品 体积/mL | 草酸溶液 体积/mL | 蒸馏水 体积/mL |
① | 4 | 60 | 10 | 30 |
② | 5 | 60 | 10 | 30 |
③ | 5 | 60 | _________ | _________ |
测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。

(2)上述反应后草酸被氧化为__________________(填化学式)。
(3)实验①和②的结果表明____________________;实验①中0~t1时间段反应速率v(Cr3+)=____________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:___________________________;
假设三:___________________________;
(5)请你设计实验验证上述假设一,完成下表中内容。[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O![]() 的浓度可用仪器测定]
的浓度可用仪器测定]
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
_____________ |
(6)某化学兴趣小组要完成中和热的测定,实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是___、_____。
(7)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。计算完成上表中的ΔH_________________________。
(8)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果ΔH____(填“偏大”或“偏小”无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
图(1) 图(2)
图(2)
图(3)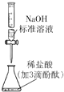 图(4)
图(4)
A. 图(1)用于除去CO2中的HCl气体
B. 图(2)表示已组装的铜锌原电池
C. 图(3)用于测定某稀盐酸的物质的量浓度
D. 用图(4)装置制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A. 用敞口容器称量KOH且时间过长
B. 配置前先向容量瓶中加入少量蒸馏水
C. 容量瓶盛过KOH溶液,使用前未洗涤
D. 溶解后快速转移到容量瓶,然后加足量蒸馏水,定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、镁、金等的相关物质在生产生活中具有重要的作用。回答下列问题:
(1)铜元素在周期表中的位置是___________,基态铜原子中,核外电子占据最高能层的符号是___________,占据该最高能层的电子数为___________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、 Cu5Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___________(填“晶体”或“非晶体”)
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,lmol(SCN)2分子中含有σ键的数目为___________。(SCN)2对应的酸有硫氰酸(H-S-C≡N)、异硫氰酸(H-N=C=S)两种。理论上前者沸点低于后者,其原因是____________________________________________。
(4)铜与金形成的金属互化物的晶胞结构如图1所示,其晶胞边长为anm,该金属互化物的密度为___________(用含a、NA的代数式表示)g·cm-3。

(6)某金属晶体中原子的堆积方式为六方最密堆积如图2所示,晶胞可用图3表示。已知该金属的原子半径为acm,该金属晶胞的高为bcm:若以晶胞中A点原子为原点建立空间直角坐标系o-xyz,则A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),则B点原子的坐标为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com