
【题目】为研究卤代烃的化学性质,某化学课外小组的学生进行了如下实验。
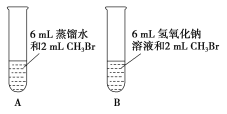
(1)甲同学设计了A、B两个实验,充分振荡反应后,甲先从试管A的水层中取出少量溶液,滴入盛装有硝酸酸化的硝酸银溶液的试管中,观察到的实验现象是____;后从试管B(NaOH溶液的浓度是0.5 mol·L-1)的水层中取出少许溶液,滴入盛有足量硝酸酸化的硝酸银溶液的试管中,观察到的实验现象是____,写出该反应的化学方程式:____。A、B两个实验说明____。
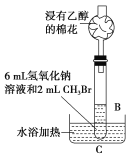
(2)乙同学在B的基础上设计装置C,研究氢氧化钠溶液和CH3Br的反应。浸有乙醇的棉花的作用是____,有人认为,控制装置C中水浴温度是本实验的关键,则应控制水浴温度低于____的沸点。
(3)丙同学将NaOH溶液的浓度从0.5 mol·L-1增大到1.0 mol·L-1、1.5 mol·L-1,经过相同的时间(试管中还有油滴)后从试管B的水层中取出少许溶液,滴入盛有足量硝酸酸化的硝酸银溶液的试管中,发现生成沉淀的质量依次增大,该现象说明____,还可以通过其他实验操作说明该结论,简述另一种实验思想:____。
【答案】无现象 有浅黄色沉淀生成 NaBr + AgNO3 = NaNO3 + AgBr↓ 甲醇发生水解反应,要在碱性条件下才反应 吸收CH3Br,防止在CH3Br逸出,污染环境 CH3Br 氢氧化钠浓度越大,水解速率越快,单位时间内生成生成的HBr越多,产生的AgBr沉淀就越多 比较生成相同量的AgBr,不同浓度NaOH消耗时间的长短
【解析】
(1)A中不反应,CH3Br是非电解质,不能直接和硝酸银反应,B中发生水解反应,水层再加入硝酸银反应生成淡黄色硝酸银。
(2)CH3Br易挥发,乙醇可以吸收CH3Br。
(3)根据NaOH溶液的浓度越大,反应速率越快,相同时间内生成NaBr越多或生成相同量的AgBr,浓度较大的NaOH溶液消耗时间越短分析。
(1)甲先从试管A的水层中取出少量溶液,滴入盛装有硝酸酸化的硝酸银溶液的试管中,两者不反应,因此观察到的实验现象是无现象;试管B中反应生成甲醇和溴化钠,后从试管B(NaOH溶液的浓度是0.5 mol·L-1)的水层中,取出少许溶液,滴入盛有足量硝酸酸化的硝酸银溶液的试管中,观察到的实验现象是有浅黄色沉淀生成,该反应的化学方程式: NaBr + AgNO3 = NaNO3 + AgBr↓,A、B两个实验说明甲醇发生水解反应,要在碱性条件下才反应;故答案为:无现象;有浅黄色沉淀生成;NaBr + AgNO3 = NaNO3 + AgBr↓;甲醇发生水解反应,要在碱性条件下才反应。
(2) CH3Br易挥发,乙醇可以吸收CH3Br,防止在加热过程中CH3Br逸散到空气中,污染环境,用温度计控制水浴加热温度且温度低于CH3Br的沸点;故答案为:吸收CH3Br,防止在CH3Br逸出,污染环境;CH3Br。
(3)滴入盛有足量硝酸酸化的硝酸银溶液的试管中,发现生成沉淀的质量依次增大,说明氢氧化钠浓度越大,水解速率越快,单位时间内生成生成的HBr越多,产生的AgBr沉淀就越多,还可以比较生成相同量的AgBr,不同浓度NaOH消耗时间的长短来说明该结论;故答案为:氢氧化钠浓度越大,水解速率越快,单位时间内生成生成的HBr越多,产生的AgBr沉淀就越多;比较生成相同量的AgBr,不同浓度NaOH消耗时间的长短。


科目:高中化学 来源: 题型:
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态Ga原子价电子排布式__________________,核外电子占据最高能级的电子云形状为_________;基态As原子最高能层上有_______个电子。
(2)镓失去电子的逐级电离能(单位:kJmol1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的第一电离能比镓_____(填“大”或“小”)。
(3)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为__________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中Ga原子的杂化方式为______,AsH3分子的空间构型为____________。
(5)相同压强下,AsH3的沸点______NH3(填“大于”或“小于”),原因为__________________
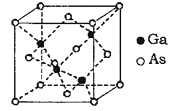
(6)GaAs为原子晶体,其晶胞结构如图所示,Ga与As以___________(填“共价键”或“离子键”)键合。设阿伏伽德罗常数的值为NA,该晶胞边长为a pm,则GaAs晶体的密度为_____gcm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成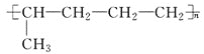 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 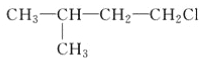 B.
B. 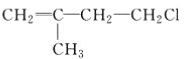 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 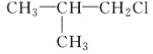
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() 、CH3CH2OH、CH3CH2Br、NH4Cl四种无色液体,只有一种试剂就能把它们鉴别开,这种试剂是( )
、CH3CH2OH、CH3CH2Br、NH4Cl四种无色液体,只有一种试剂就能把它们鉴别开,这种试剂是( )
A.溴水B.NaOH溶液C.Na2SO4溶液D.KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示盐酸滴加到0.1 mol·L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂。
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂。
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)![]() CH3OH(g),该反应的ΔH=-91kJ/mol。
CH3OH(g),该反应的ΔH=-91kJ/mol。
D.图4表示物质的量之比为2∶3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)与时间(t)的关系。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是
2SO3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,v(SO2)与 v(SO3)相等
D.容器内气体的浓度 c(SO2)∶c(O2)∶c(SO3)=2∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)醋酸可通过分子间氢键双聚形成八元环,画出该结构_____。(以 O…H—O 表示氢键)
(2)已知碳化镁 Mg2C3可与水反应生成丙炔,画出 Mg2C3的电子式_____。
(3)工业上,异丙苯主要通过苯与丙烯在无水三氯化铝催化下反应获得,写出该反应方程式_____。
(4)将乙酸乙酯与H218O混合后,加入硫酸作催化剂,乙酸乙酯在加热条件下将发生水解反应,写出产物中不含18O的物质的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
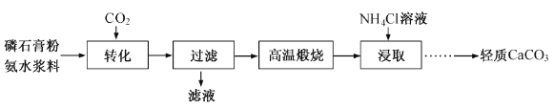
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由右图。清液pH>11时CaSO4转化的离子方程式_____________;能提高其转化速率的措施有____(填序号)
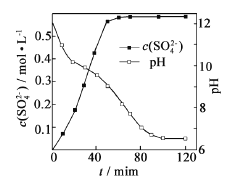
A.搅拌浆料 | B.加热浆料至100℃ |
C.增大氨水浓度 | D.减小CO2通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com