
 ,则原混合气体的平均相对分子质量不可能是
,则原混合气体的平均相对分子质量不可能是 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,相当于是H2、CO与过氧化钠直接发生化合反应,恢复到原温度,容器内的压强为原来的
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,相当于是H2、CO与过氧化钠直接发生化合反应,恢复到原温度,容器内的压强为原来的 ,剩余气体为O2,不可能为H2或CO.令原混合物的物质的量为4mol,则反应后氧气的物质的量为1mol,由方程式可知原混合物中二氧化碳为2mol,氢气与CO共4mol-2mol=2mol,利用端值法讨论判断混合气体的平均相对分子质量的范围.
,剩余气体为O2,不可能为H2或CO.令原混合物的物质的量为4mol,则反应后氧气的物质的量为1mol,由方程式可知原混合物中二氧化碳为2mol,氢气与CO共4mol-2mol=2mol,利用端值法讨论判断混合气体的平均相对分子质量的范围. 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,相当于是H2、CO与过氧化钠直接发生化合反应,恢复到原温度,容器内的压强为原来的
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,相当于是H2、CO与过氧化钠直接发生化合反应,恢复到原温度,容器内的压强为原来的 ,剩余气体为O2,不可能为H2或CO,
,剩余气体为O2,不可能为H2或CO,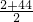 =23,
=23,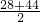 =36,
=36,

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市奉贤区高三上学期期末教学质量调研化学试卷(解析版) 题型:选择题
将一定量的H2、CO和CO2的混合气体通入盛有足量Na2O2粉末(Na2O2体积忽略不计)的密闭容器中,用电火花引燃直至反应完全。恢复到原温度,容器内的压强为原来的1/4,则原混合气体的平均相对分子质量不可能是
A.15 B.28 C.30 D.36
查看答案和解析>>
科目:高中化学 来源:2012年上海市长宁区高考化学二模试卷(解析版) 题型:选择题
 ,则原混合气体的平均相对分子质量不可能是( )
,则原混合气体的平均相对分子质量不可能是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com