

分析 (1)在氧化还原反应中,化合价升高的元素发生还原反应;
(2)电解饱和食盐水的方法制备氯气,阳极,溶液中氯离子失电子发生氧化反应生成氯气,阴极,溶液中氢离子得到电子发生还原反应,生成氢气;
(3)①SiCl4遇水剧烈水解生成SiO2和一种酸,据此信息找出反应物和生成物,结合质量守恒书写化学方程式;
②水的沸点为100℃,浓硫酸具有吸水性,溶于水放热,据此解答;
(4)①△H<0表示放热,根据平衡移动的原理解答;
②反应2与反应1比较,反应2产物为固体和气体比反应1更易于分离,反应3与反应2比较,温度高,反应速率更快;
③根据盖斯定律可以计算化学反应的焓变;
(5)氟化氢跟二氧化硅反应生成四氟化硅和水,四氟化硅和氟化氢直接反应生成H2SiF6.
解答 解:(1)在过程Ⅰ中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中,C从0价变为一氧化碳中的+2价,发生氧化反应是还原剂,故答案为:还原;
(2)电解饱和食盐水的方法制备氯气,阳极,溶液中氯离子失电子发生氧化反应生成氯气,2Cl--2e=Cl2↑,阴极,溶液中氢离子得到电子发生还原反应,生成氢气,2H++2e-═H2↑,总的反应为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
(3)①根据SiCl4遇水剧烈水解生成SiO2和一种酸信息,反应物是SiCl4和水,生成物为二氧化硅,根据氧原子守恒,水分子前的系数为2,根据氢原子和氯原子守恒,另一产物为氯化氢,氯化氢前的系数为4,可知化学反应方程式为SiCl4+2H2O═SiO2+4HCl,
故答案为:SiCl4+2H2O═SiO2+4HCl;
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,此时使水蒸气冷凝,然后再通入到浓H2SO4中,进入浓硫酸的水量少了,保证浓硫酸的良好吸水性,水和浓硫酸作用放热,所以进入硫酸的水少了,能降低放出的热量,
故答案为:使水蒸气冷凝减少进入浓硫酸的水量保持持续的吸水性并降低放出的热量;
(4)①对于三个反应,反应热都是△H<0表示放热,
a.升高温度,平衡向吸热的方向移动,所以会降低SiCl4的转化率,故a错误;
b.Si遇氧气在高温的条件下反应生成二氧化硅,所以还原过程需在无氧的气氛中进行,b正确;
c.有气体参加的反应,增大压强,能加快反应的速率,对于三个反应,都有气体参与,所以增大压强,能提高反应的速率,故c正确;
d.Na、Mg都是还原性比较强的金属,可以代替Zn还原SiCl4,故d正确;
故答案为:bcd;
②反应2与反应1比较,反应2产物为固体和气体比反应1更易于分离,反应3与反应2比较,反应物都为气态,温度高,反应速率更快,所以实际制备过程选择“反应3”,温度高反应速率快;与前两个反应比较更易于使硅分离使化学平衡向右移动提高转化率,
故答案为:温度高反应速率快;与前两个反应比较更易于使硅分离使化学平衡向右移动提高转化率;
③每投入1mol SiCl4,有2molZn参加反应,“反应3”与“反应2”比较,反应2中锌为液态,根据Zn(l)═Zn(g)△H=+116KJ/mol,若SiCl4的转化率均为90%,“反应3”比“反应2”多放出116KJ/mol×2×90%=208.8KJ,
故答案为:208.8;
(5)二氧化硅和氢氟酸:SiO2+4HF=SiF4↑+2H2O;SiF4+2HF=H2SiF6,所以用稀HNO3和HF的混合液,硅表面首先形成SiO2,最后转化为H2SiF6的化学方程式为SiO2+6HF═H2SiF6+2H2O,
故答案为:SiO2+6HF═H2SiF6+2H2O.
点评 本题考查锌还原四氯化硅制备硅,涉及化学平衡移动、电解等知识,掌握平衡移动原理的运用,掌握硅及其化合物的性质是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | (b-2a)bmol•L-1 | B. | $\frac{(b-2a)}{2}$bmol•L-1 | C. | (2b-a)bmol•L-1 | D. | $\frac{(2b-a)}{2}$bmol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,它们的部分转化关系如图(部分反应物或生成物省略).
A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,它们的部分转化关系如图(部分反应物或生成物省略). ,C的俗名为火碱或烧碱;
,C的俗名为火碱或烧碱;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 苯酚 | 94 | 1.0722 | 182 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 异丙苯 | 120 | 0.8640 | 153 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
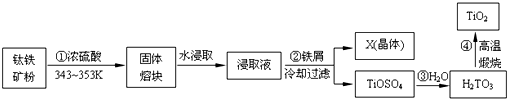
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
| 实验步骤 | 实验现象 | 实验结论 |
| ① | 溶液X中含有Na+ | |
| ② | 溶液X中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com