
1﹣丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
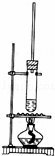
|
| A. | 不能用水浴加热 |
|
| B. | 长玻璃管有冷凝回流作用 |
|
| C. | 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 |
|
| D. | 加入过量乙酸可以提高1﹣丁醇的转化率 |
考点:
乙酸乙酯的制取.
专题:
有机物的化学性质及推断.
分析:
A、水浴加热适合温度低于100℃的反应;
B、有机物易挥发,长导管可起冷凝作用;
C、酯类在碱性条件下水解;
D、根据平衡移动原理考虑.
解答:
解:A、因此反应需要反应温度为115~125℃,而水浴加热适合温度低于100℃的反应,故A正确;
B、有易挥发的液体反应物时,为了避免反应物损耗和充分利用原料,要在发生装置设计冷凝回流装置,使该物质通过冷凝后由气态恢复为液态,从而回流并收集.实验室可通过在发生装置安装长玻璃管或冷凝回流管等实现,故B正确;
C、使用氢氧化钠溶液洗涤,会使乙酸乙酯发生水解而使乙酸丁酯损失,故C错误;
D、酯化反应为可逆反应,增加乙酸的量,可使平衡向生成酯的方向移动,从而提高1﹣丁醇的转化率,故D正确.
故选C.
点评:
本题考查了酯的制取,掌握乙酸乙酯的制取是类推其他酯的制取的基础,注意装置中各部分的作用及酯的性质来解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在BaSO3(s)⇌Ba2+(aq)+SO32﹣ (aq)平衡体系中,下列措施可使沉淀量减少的是( )
|
| A. | 加入K2SO3(s) | B. | 加入稀HNO3 | C. | 加入稀盐酸 | D. | 加入K2SO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应原理在生产、生活、国防上有重要的应用.例如:
联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
①已知:2NO2(g)⇌N2O4(g)△H=﹣57.20kJ•mol﹣1.
一定温度下,在密闭容器中反应2NO2(g)⇌N2O4(g)达到平衡.
其他条件不变时,下列措施能提高NO2转化率的是 (填字母).
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
②下表为反应2NO2(g)⇌N2O4(g)在17℃、1.01×105Pa下的部分实验数据:
| 时间/s | 0 | 80 | 160 | 240 | 320 |
| c(NO2)/mol•L﹣1 | 0.0540 | 0.0420 | 0.0340 | 0.0300 | 0.0300 |
| c(N2O4)/mol•L﹣1 | 0 | 0.0060 | 0.0100 | 0.0120 | 0.0120 |
该温度下反应N2O4(g)⇌2NO2(g)的平衡常数K的值为 .
(写出计算过程)
③25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.
则该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、CO32﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是()
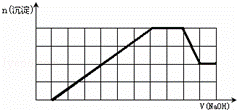
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42﹣和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作可以达到实验目的是( )
| 实验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 检验淀粉水解产物的还原性 | 取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现白色沉淀 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 乙酸与碳酸钠溶液反应:2H++CO32﹣═CO2↑+H2O |
|
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO﹣+2H2O |
|
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O |
|
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。


(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的是( )
|
| A. | 金刚石 石墨 | B. | H2S CCl4 | C. | NH4Cl KCl | D. | CO2 SiO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com