
【题目】将9.6g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应.假定溶液体积不变,请回答下列问题:(要求写出计算过程) 
(1)反应生成的气体的体积(标况下);
(2)反应过程中转移电子的物质的量;
(3)参加反应的稀硝酸的物质的量浓度.
科目:高中化学 来源: 题型:
【题目】呋喃甲酸是抗菌素一种,在食品工业中作防腐剂,也作涂料添加剂、医药、香料等中间体,可用呋喃甲醛制备,其实验原理和制备步骤如下:
![]()
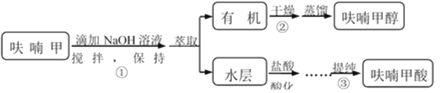
步骤③提纯过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥。
已知:①呋喃甲酸在100℃升华,133℃熔融,230-232℃沸腾,并在此温度下脱羧;
②呋喃沸点为31-32℃,易溶于水;
③无水氯化钙能与醇形成复合物。
(1)步骤①的关键是控制温度,其措施有:磁力搅拌、______和______。
(2)步骤②中干燥所使用的干燥剂可选用______。
A.98%浓硫酸 B.无水硫酸镁
C.无水碳酸钠 D.无水氯化钙
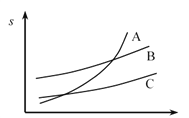
(3)呋喃甲酸在A、B、C三种溶剂中溶解度(s)随温度变化的曲线如图:步骤③提纯时,合适的溶解溶剂是______,其理由______。
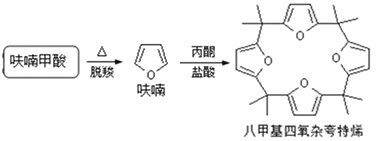
(4)利用呋喃甲酸可以制取八甲基四氧杂夸特烯。
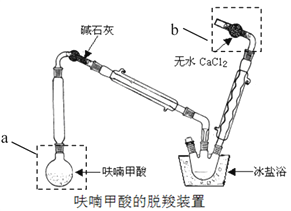
①仪器a的名称:______,装置b的作用:______,
②脱羧装置中用冰盐浴的目的是______;
③确定产品为八甲基四氧杂夸特烯,可通过测定沸点,还可采用的检测方法有______。
④若用4.5g呋喃甲酸制得了0.5g八甲基四氧杂夸特烯(M=432g·mol-1),则产率为______(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中可以大量共存的是
A.Na+、Fe3+、SO42-、SCN-B.K+ 、OH-、AlO2-、Cl-
C.H+ 、Na+、Fe2+、MnO4-D.Na+、H+、HCO3-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( )
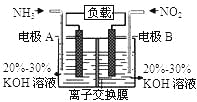
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48L NO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g),现向一容积不变的2L密闭容器中充入4mol NH3和3mol O2,4min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是
2N2(g)+6H2O(g),现向一容积不变的2L密闭容器中充入4mol NH3和3mol O2,4min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是
A. v(O2)=0.225 mol·L-1min-1
B. v(H2O)=0.375 mol·L-1min-1
C. v(N2)=0.125 mol·L-1min-1
D. v(NH3)=0.250 mol·L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。

(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘的制取。甲、乙两种实验方案如下:
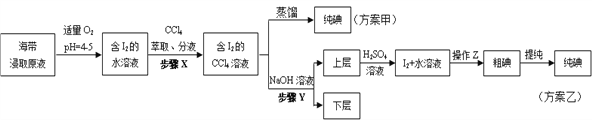
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(1)分液漏斗使用前须检漏,检漏方法为_____________
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________
(3)下列有关步骤Y的说法,正确的是_____________
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.操作Z的名称是过滤 D.NaOH溶液可以由乙醇代替
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com