
 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,并注意标明物质的聚集状态和对应反应的焓变写出热化学方程式;
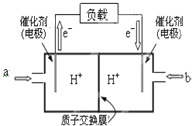
(2)根据电子流向可知c为负极,负极发生氧化反应,溶液中阳离子移向正极,甲醇失电子被氧化在酸溶液中生成二氧化碳和水,结合电荷守恒和原子守恒书写;
(3)根据反应热等于反应物的总键能-生成物的总键能求算;
(4)利用盖斯定律计算反应热,利用盖斯定律将①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$得到热化学方程式;
解答 解:(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知c电极为负极,甲醇在负极上发生氧化反应,氢离子移向右侧为正极,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,
故答案为:a;右;CH3OH-6e-+H2O=CO2+6H+;
(3)已知反应N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1,△H=945kJ•mol-1+436kJ•mol-1×3-akJ•mol-1×6=-93kJ•mol-1,a=+391 kJ•mol-1,
故答案为:+391 kJ•mol-1;
(4)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
利用盖斯定律将①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+$\frac{1}{2}$×(-571.6kJ/mol)-$\frac{1}{2}$×(-2599 kJ/mol)=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.
点评 本题考查了热化学方程式的书写、原电池原理以及电极反应式的书写、据键能计算焓变、盖斯定律的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 氮元素只被氧化 | |
| B. | 豆科植物根瘤菌固氮属于自然固氮 | |
| C. | 其它元素也参与了氮循环 | |
| D. | 含氮无机物和含氮有机物可相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 29g•mol-1 | B. | 29g | C. | 58g•mol-1 | D. | 58g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )| A. | 电解前CuSO4溶液的物质的量浓度为2mol/L | |
| B. | 电解后所得溶液中c(H+)=2mol/L | |
| C. | 当n(e-)=0.6mol时,V(H2):V(O2)=2:3 | |
| D. | 向电解后的溶液中加入16gCuO,则溶液可恢复为电解前的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
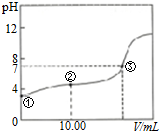
| A. | 两溶液反应的离子方程式是H++OH-+H2O | |
| B. | 图中②点所示溶液中:2c(Na+)=c(HA)+c(A-) | |
| C. | 图中②点所示溶液中:c(A-)>c(H+)>c(HA)>c(OH-) | |
| D. | 图中③点所示滴入的NaOH溶液的体积V=20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子直径的大小 | B. | 分子数目的多少 | ||
| C. | 组成分子的原子个数 | D. | 分子间距离的大小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com