
【题目】如图所示是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:

(1)盛放浓盐酸的仪器名称为__。
(2)烧瓶中发生反应的离子方程式为__。
(3)C瓶中的试剂是__,其作用是__。
(4)玻璃管D中发生反应的化学方程式是__,反应现象是__。
(5)干燥管E中盛有碱石灰(CaO+NaOH),其作用是__。
【答案】分液漏斗 4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O 浓硫酸 干燥氯气 Cu+Cl2
Mn2++Cl2↑+2H2O 浓硫酸 干燥氯气 Cu+Cl2![]() CuCl2 产生棕黄色的烟 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D
CuCl2 产生棕黄色的烟 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D
【解析】
(1)盛放浓盐酸的仪器是分液漏斗;
(2)装置A是制取氯气的发生装置,烧瓶中发生的反应是二氧化锰与浓盐酸在加热的条件下生成氯化锰、氯气与水;
(3)实验制取无水氯化铜,进入装置D的氯气应干燥,装置C的作用是干燥氯气,盛放的试剂是浓硫酸;
(4)玻璃管D中Cu与氯气反应制取氯化铜,铜与氯气反应生成氯化铜,产生棕黄色的烟;
(5)氯气有毒,反应后的尾气中含有氯气,直接排放到空气中会污染大气;实验制备无水氯化铜,空气中的水蒸气进入装置D会影响无水氯化铜的制备。
(1)盛放浓盐酸的仪器是分液漏斗;
(2)装置A是制取氯气的发生装置,烧瓶中发生的反应是二氧化锰与浓盐酸在加热的条件下生成氯化锰、氯气与水,反应方程式为:4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O,则发生反应的离子方程式为4H++2Cl-+MnO2
MnCl2+Cl2↑+2H2O,则发生反应的离子方程式为4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)实验制取无水氯化铜,进入装置D的氯气应干燥,装置C的作用是干燥氯气,盛放的试剂是浓硫酸;
(4)玻璃管D中Cu与氯气反应制取氯化铜,铜与氯气反应生成氯化铜,反应方程式为:Cu+Cl2 ![]() CuCl2,反应现象是:产生棕黄色的烟;
CuCl2,反应现象是:产生棕黄色的烟;
(5)氯气有毒,反应后的尾气中含有氯气,直接排放到空气中会污染大气;实验制备无水氯化铜,空气中的水蒸气进入装置D会影响无水氯化铜的制备,故干燥管E中盛有碱石灰,其作用是:吸收尾气中未反应的氯气和防止空气中水蒸汽进入装置D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是 ( )
A. 室温下,pH=3的氢氟酸加水稀释后,电离常数Ka(HF)和pH均减小
B. 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
C. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
D. 室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理、有关数据及装置示意图如下:

名词 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 112.4(100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
苯甲酸在水中的溶解度如表:
温度/℃ | 4 | 18 | 75 |
溶解度/g | 0.2 | 0.3 | 2.2 |
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:

一、制备苯甲酸
在b中加入2.7mL甲苯、100mL
二、分离提纯
在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,挤压去水分后放在沸水浴上干燥,得到粗产品。
三、测定纯度
称取m g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶中,滴加2~3滴酚酞,然后用标准浓度的KOH溶液滴定。
请回答下列问题:
(1)装置b的名称是__________________,装置a的作用为_____________________________。
(2)分离提纯过程中加入的草酸是一种二元弱酸,反应过程中有酸式盐、无色气体和黑色固体生成。加入草酸的作用是_________________________,请用离子方程式表示反应的原理______________________________。
(3)产品减压过滤时用冷水洗涤的原因是__________________________________________。
(4)选用下列__________操作,可以将粗产品进一步提纯。(选填字母)
A.溶于水后过滤 B.溶于乙醇后蒸馏 C.用甲苯萃取后分液 D.升华
(5)测定纯度步骤中,判断滴定终点的标志是________________________________________________。若m=1.200g,滴定时用去0.1200mol· L-1标准KOH溶液18.00mL,则所得产品中苯甲酸的质量分数为__________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol1
CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol1
②CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=890.3 kJ·mol1
CO2(g)+2H2O(l) ΔH=890.3 kJ·mol1
③CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=890.3 kJ·mol1
CO2(g)+2H2O(g) ΔH=890.3 kJ·mol1
④2H2(g)+O2(g)![]() 2H2O(l) ΔH=571.6 kJ·mol1
2H2O(l) ΔH=571.6 kJ·mol1
A. 仅有② B. 仅有②④ C. 仅有②③④ D. 全部符合要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室探究制备高锰酸钾的绿色化方案,其实验流程如下:
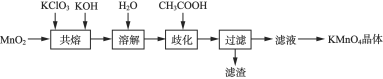
已知:![]() 水溶液呈墨绿色,在酸性、中性和弱碱性环境下,
水溶液呈墨绿色,在酸性、中性和弱碱性环境下,![]() 会发生自身氧化还原(歧化)反应,生成
会发生自身氧化还原(歧化)反应,生成![]() 和
和![]() ;部分试剂熔点、分解温度见下表:
;部分试剂熔点、分解温度见下表:
物质 |
|
|
|
|
|
熔点/ | 406 | 368 | —— | —— | —— |
分解温度/ | 1323 |
| 530 | 190 | 240 |
(1)在强碱性条件下,![]() 与
与![]() 共熔可制得
共熔可制得![]() ,其化学方程式为________。投料的顺序为先加入
,其化学方程式为________。投料的顺序为先加入![]() 和
和![]() 混合均匀,待小火完全熔融,再加入
混合均匀,待小火完全熔融,再加入![]() ,迅速搅拌。不能先将
,迅速搅拌。不能先将![]() 与
与![]() 混合的原因是________。
混合的原因是________。
(2)溶解后所得溶液转入三颈瓶中,趁热滴入![]() 的乙酸,调节
的乙酸,调节![]() ,在如下图所示的装置中进行歧化。
,在如下图所示的装置中进行歧化。
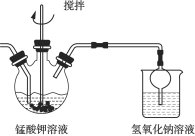
①该步骤中如果pH控制过高,可能会导致________。
②判断三颈瓶中![]() 完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到________,表示
完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到________,表示![]() 已完全反应。
已完全反应。
(3)从提高原料利用率的角度分析,本实验流程的优点是________________。
(4)设计以滤液为原料,制取![]() 晶体的实验方案:________________(已知
晶体的实验方案:________________(已知![]() 在水溶液中,
在水溶液中,![]() 以上开始分解。实验中必须使用的设备:蒸发皿、恒温水浴槽、恒温干燥箱)。
以上开始分解。实验中必须使用的设备:蒸发皿、恒温水浴槽、恒温干燥箱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X、Y均具有抗真菌、抗炎、植物毒性及细胞毒性等功能。下列有关化合物X、Y的说法正确的是( )
 化合物X
化合物X 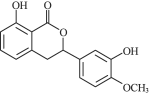 化合物Y
化合物Y
A.X、Y属于同系物
B.![]() 最多能与
最多能与![]() 发生取代反应
发生取代反应
C.Y在酸性条件下水解,水解产物可发生消去反应
D.X、Y分别与足量![]() 加成的产物分子中手性碳原子数目相等
加成的产物分子中手性碳原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
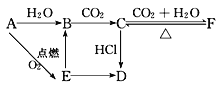
(1)写出A、B、C、D、E、F的化学式:A.__________;B.__________;C.__________;D.__________;E.__________;F.__________。
(2)写出有关反应的离子方程式
B→C:__________________________________。
E→B:___________________________________。
C→F:___________________________________。
(3)写出F→C的化学方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com