
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0mol?L-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1
C
【解析】由溶液 pH计算表达式可得,c(H+)=10-pHmol/L,则pH=4的醋酸中c(H+)=10-4
mol?L-1,A项错误;小苏打的化学式是NaHCO3,属于钠盐、酸式盐,在水中能完全电离,即NaHCO3="=" Na++HCO3-,钠离子不能水解,而HCO3-不仅少部分水解生成碳酸,还有少部分HCO3-电离出碳酸根离子,即HCO3-+H2O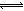 H2CO3+OH-、HCO3-
H2CO3+OH-、HCO3-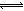 H++CO32-,且其水解程度大于电离程度,则饱和小苏打溶液中:c(Na+)>c(HCO3-),B项错误;饱和食盐水中溶质为NaCl、溶剂为H2O,前者全部电离为Na+、Cl-,后者部分电离为OH-、H+,根据电荷守恒原理可得:c(Na+)+
c(H+)= c(Cl-)+c(OH-),C项正确;25℃时Kw= c(H+)?c(OH-)=1.0×10-14,水的电离是吸热反应,升高温度能促使H2O
H++CO32-,且其水解程度大于电离程度,则饱和小苏打溶液中:c(Na+)>c(HCO3-),B项错误;饱和食盐水中溶质为NaCl、溶剂为H2O,前者全部电离为Na+、Cl-,后者部分电离为OH-、H+,根据电荷守恒原理可得:c(Na+)+
c(H+)= c(Cl-)+c(OH-),C项正确;25℃时Kw= c(H+)?c(OH-)=1.0×10-14,水的电离是吸热反应,升高温度能促使H2O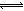 H++OH-的电离平衡右移,则50℃时Kw= c(H+)?c(OH-)>1.0×10-14,pH=12的纯碱溶液中c(H+)=10-pHmol/L=10-12mol/L,c(OH-)= Kw/ c(H+)>1.0×10-2molL-1,D项错误。
H++OH-的电离平衡右移,则50℃时Kw= c(H+)?c(OH-)>1.0×10-14,pH=12的纯碱溶液中c(H+)=10-pHmol/L=10-12mol/L,c(OH-)= Kw/ c(H+)>1.0×10-2molL-1,D项错误。
【考点定位】本题考查考生对溶液pH的了解;考查考生对盐类水解、弱电解质在水中的电离的了解;考查考生对水溶液中离子浓度大小的比较;考查考生对水的电离平衡和离子积常数的了解;考查考生对温度与平衡常数大小关系的了解。


科目:高中化学 来源: 题型:
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0mol·L-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1 ks5u
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省潍坊高密市高三4月月考理综化学试卷(解析版) 题型:选择题
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)= 4.0molL-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)= 1.0×10-2 molL-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省高三上学期期中考试化学试卷(解析版) 题型:选择题
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.饱和纯碱(Na2CO3)溶液中:c(Na+)=2c(CO32-)
B.pH=4的醋酸中:c(H+)=1.0×10-4mol·L-1
C.0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com