
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:(以下均假设反应过程中溶液体积不变).
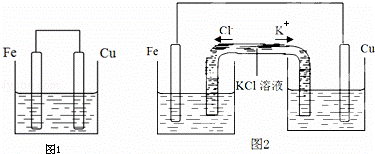
(1)铁片上的电极反应式为 .
(2)铜片周围溶液会出现 的现象.
(3)若2min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为 mol;
②该段时间内用硫酸铜表示的平均反应速率为 mol•L﹣1•min﹣1
(4)若一段时间后测得铁片减少了2.4g,同时铜片增加了3.2g,计算这段时间内该装置消耗的化学能转化为电能的百分比为 .
(5)若将该装置改为如图2所示的装置也能达到和原装置相同的作用.其中KCl溶液起沟通两边溶液形成闭合回路的作用,同时又能阻止反应物直接接触.则硫酸铜溶液应该注入 (填“左侧”、“右侧”或“两侧”)烧杯中.
考点:
原电池和电解池的工作原理.
专题:
电化学专题.
分析:
(1)该装置构成原电池,铁易失电子而作负极,铜作正极,铁电极上铁失电子而发生氧化反应;
(2)铜电极上铜离子得电子发生还原反应;
(3)①负极上铁溶解,正极上析出铜,铁片和铜片相差的质量为溶解铁和析出铜的质量之和,溶解铁的物质的量和析出铜的物质的量相等,根据金属和转移电子之间的关系式计算;
②根据铜离子的物质的量计算平均反应速率;
(4)由于Fe与硫酸铜溶液直接接触,部分Fe发生原电池反应,另一部分直接与铜离子发生置换反应,根据Fe发生两种反应的量来求算;
(5)含有盐桥的原电池中,电极材料与相应的电解质溶液中含有相同的金属元素.
解答:
解:(1)该装置构成原电池,铁易失电子而作负极,铜作正极,铁电极上铁失电子而发生氧化反应,电极反应式为:Fe﹣2e﹣=Fe2+,
故答案为:Fe﹣2e﹣=Fe2+;
(2)铜电极上铜离子得电子发生还原反应而生成铜,所以铜离子浓度降低,则溶液颜色变浅,故答案为:溶液颜色变浅;
(3)①负极上铁溶解,正极上析出铜,铁片和铜片相差的质量为溶解铁和析出铜的质量之和,溶解铁的物质的量和析出铜的物质的量相等,设转移电子的物质的量为xmol,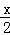 ×56+
×56+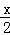 ×64=1.24,x=0.02,
×64=1.24,x=0.02,
故答案为:0.02;
②铜离子的浓度变化为: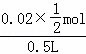 =0.02mol/L,则该段时间内用硫酸铜表示的平均反应速率为
=0.02mol/L,则该段时间内用硫酸铜表示的平均反应速率为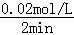 =0.01mol•L﹣1•min﹣1;
=0.01mol•L﹣1•min﹣1;
故答案为:0.01;
(4)铁电极的电子一部分传给铜电极,发生原电池反应.同时铁电极上也发生置换反应.电极反应:Fe﹣2e﹣→Fe2+,Cu2++2e﹣=Cu,铜电极增加3.2g,即0.05mol,同时铁电极原电池反应产生0.05molFe2+,即铁电极减少56g/mol×0.05mol=2.8g,但是铁片只减少了2.4g,因为铁片有一部分直接发生置换反应,有铜生成,所以质量增加了,这部分铁的化学能没有转化为电能,所以有2.8g﹣2.4g=0.4g的质量差,设有xmol铁直接参与置换反应,
Cu2++Fe=Cu+Fe2+△m
1mol 8
x 0.4
计算得x=0.05mol,即直接发生置换反应的铁为0.05mol,参与原电池反应的铁也是0.05mol,所以该装置消耗化学能有50%转化为电能;
故答案为:50%;
(5)含有盐桥的原电池中,电极材料与相应的电解质溶液中含有相同的金属元素,所以硫酸铜溶液应该倒入右侧,故答案为:右侧.
点评:
本题考查学生原电池的工作原理,结合了化学反应速率知识来考查,综合性强,难度较大,注意根据原电池中正负极上发生的电极反应来分析解答.


科目:高中化学 来源: 题型:
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途.
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图.
①下列对尼泊金酯的判断不正确的是 .
a.能发生水解反应 b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上 d.与浓溴水反应时,1mol尼泊金酯消耗1mol Br2
②尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是 .
(2)C8H8O3的另一种同分异构体甲满足以下条件:
①与足量的NaOH溶液完全反应时,1mol甲消耗3molNaOH
②遇FeCl3溶液显色③苯环上的一氯取代物只有一种
甲可能的结构简式是 、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度时,水的离子积为1.0×10-12 mol2·L-2,若该温度下某溶液中[H+]为1.0×10-7 mol·L-1,则该溶液( )
A.呈碱性 B.呈酸性 C.呈中性 D.[OH-]=1 000[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的锌粉和6mol•L﹣1的过量盐酸反应,当向其中加入少量的下物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是( )
|
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑧ | D. | ①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在1LK2SO4和CuSO4的混合溶液中,c(SO42﹣)=2.0mol•L﹣1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中K+的物质的量浓度为( )
|
| A. | 2.0mol•L﹣1 | B. | 1.5mol•L﹣1 | C. | 1.0mol•L﹣1 | D. | 0.5mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于次氯酸性质的描述,错误的是( )
|
| A. | 不稳定,易分解放出氧气 | B. | 能使潮湿的有色布条褪色 |
|
| C. | 具有漂白作用和消毒作用 | D. | 是一种比碳酸酸性强的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F、G七种核电荷数小于18的元素,它们的原子序数一次递增.其中:A原子核内无中子,B原子最外层电子数是次外层的2倍,D原子最外层电子数是其电子层数的3倍,E原子核外第一层比第三层电子数多1,F的最外层电子数等于第一层电子数,G形成的﹣1价离子与Ar原子核外电子排布相同;
由此推知:
(1)A原子符号是 ;
(2)B原子结构示意图是
(3)G元素形成的单质与A、D、E三元素形成呈碱性的化合物反应的离子方程式:
单质F分别在C单质、BD元素形成的化合物中燃烧的化学方程式: ; .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com