
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
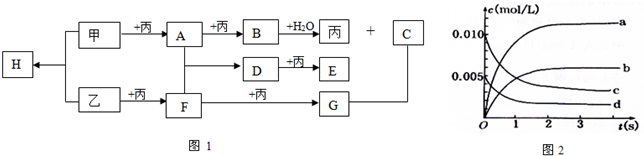
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(F)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 能源是人类生存和发展的重要支柱.研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-bkJ?mol-1,CH3OH的燃烧热△H3=-ckJ?mol-1.请根据以上信息,回答下列有关问题:
能源是人类生存和发展的重要支柱.研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-bkJ?mol-1,CH3OH的燃烧热△H3=-ckJ?mol-1.请根据以上信息,回答下列有关问题:| a+c-b |
| 2 |
| a+c-b |
| 2 |
| e |
| 2 |
| e |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
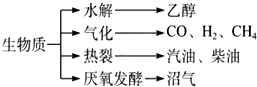
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | C-C | C-H | H-H | S-H | S-S | S-C |
| 键能/kJ.mol-1 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届湖南省四市九校高三上学期第一次联考化学试卷 题型:填空题
下图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分,②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%,回答下列问题(每空2分,共12分)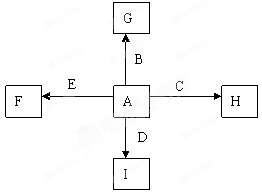
(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是 键(填“离子”或“极性”或“非极性”)
(3)称取11.9gB、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液,加入过量的NaOH溶液使其中的金属离子完全沉淀,则沉淀的质量为( )
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 ,欲检验其中的Fe2+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红 褐色
褐色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com