
(11分)有关短周期元素X、Y、Z、M、N的信息如下:
元素 | 有关信息 |
X | X元素的原子最外层电子数是电子层数的3倍 |
Y | Y元素所在主族序数与所在周期序数之差为4,Y是同周期中原子半径最小的元素 |
Z | Z元素的单质在X元素的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
M | M元素的最高价氧化物对应的水化物能与M元素的最简单气态氢化物反应生成盐R |
N | N的化合物在灼烧时焰色呈黄色 |
请回答下列问题:
(1)Z元素在第____ 周期第 族。
(2)Y元素的简单阴离子结构示意图为 ,Y与Z元素的气态氢化物稳定性顺序为____>(写化学式)。
(3)化合物N2X2与CO2反应的化学方程式为 。
(4)盐R中含有的化学键类型有 。盐R的水溶液显酸性,用离子方程式表示其盐溶液显酸性的原因为 。
(5)电解盐NY水溶液的化学方程式为 。
(11分)(1)三, (各1分);(2)Cl,
(各1分);(2)Cl,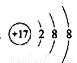 ,(1分),HCl>H2S(1分);
,(1分),HCl>H2S(1分);
(3)2Na2O2+2CO2=2Na2CO3+O2 (2分);(4)离子键、共价键(或极性共价键)、配位键(1分);
NH4++H2O NH3·H2O+H+(2分);(5)2NaCl+2H2O
NH3·H2O+H+(2分);(5)2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分)
【解析】
试题分析:根据题意可推知X是O;Y是Cl;Z是S;M是N;N是Na。(1)16号元素S元素在第三周期第 族。(2)Y元素的简单阴离子结构示意图为
族。(2)Y元素的简单阴离子结构示意图为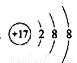 ;元素的非金属性越强,其简单的气态氢化物的稳定性就越强。由于元素的非金属性Cl>S,所以氢化物的稳定性HCl>H2S;(3)化合物Na2O2与CO2发生反应产生碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;(4)N的最高价氧化物对应的水化物是HNO3,氢化物是NH3,二者反应产生的盐是NH4NO3,盐R中含有的化学键类型有离子键、极性共价键、配位键;盐R的水溶液显酸性,原因是该盐是强酸弱碱盐,NH4+发生水解反应,消耗水电离产生的OH-,破坏了水的电离平衡,当最终达到平衡时,溶液中c(H+)>c(OH-),所以溶液显碱性,用离子方程式表示为NH4++H2O
;元素的非金属性越强,其简单的气态氢化物的稳定性就越强。由于元素的非金属性Cl>S,所以氢化物的稳定性HCl>H2S;(3)化合物Na2O2与CO2发生反应产生碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;(4)N的最高价氧化物对应的水化物是HNO3,氢化物是NH3,二者反应产生的盐是NH4NO3,盐R中含有的化学键类型有离子键、极性共价键、配位键;盐R的水溶液显酸性,原因是该盐是强酸弱碱盐,NH4+发生水解反应,消耗水电离产生的OH-,破坏了水的电离平衡,当最终达到平衡时,溶液中c(H+)>c(OH-),所以溶液显碱性,用离子方程式表示为NH4++H2O NH3·H2O+H+;(5)电解盐NaCl水溶液,由于阳离子的放电能力H+>Na+,所以H+在阴极放电产生氢气,该电极的电极反应式是:2H++2e-=H2↑;由于H+放电破坏了附近的水的电离平衡,使附近的溶液显碱性,溶液中的阴离子的放电能力:Cl->OH-,所以Cl-在阳极发生产生氯气,反应的方程式是:2Cl-—2e-=Cl2↑。电解的总化学方程式为2NaCl+ 2H2O
NH3·H2O+H+;(5)电解盐NaCl水溶液,由于阳离子的放电能力H+>Na+,所以H+在阴极放电产生氢气,该电极的电极反应式是:2H++2e-=H2↑;由于H+放电破坏了附近的水的电离平衡,使附近的溶液显碱性,溶液中的阴离子的放电能力:Cl->OH-,所以Cl-在阳极发生产生氯气,反应的方程式是:2Cl-—2e-=Cl2↑。电解的总化学方程式为2NaCl+ 2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
考点:考查元素的推断、元素在周期表中的位置、元素非金属性强弱比较、化学方程式的书写、盐的水解、电解原理的应用的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年上海市黄浦区高三上学期期末调研测试化学试卷(解析版) 题型:选择题
在下列变化过程中,被破坏的作用力正确的是
A.干冰升华一一共价键
B.二氧化硅熔融——范德华力
C.氢氧化钠熔融——离子键、共价键
D.硫酸氢钠溶于水——离子键、共价键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:实验题
(本题共12分)
油脂是高级脂肪酸的甘油酯,在工业上用途广泛。
实验一:用地沟油制肥皂(高级脂肪酸钠盐)和甘油(常压下甘油的沸点为290℃)。
32.将约6g地沟油、10mL 40%的烧碱溶液、5mL液体A混合后在烧杯中加热约0.5小时。A可以增大反应物间的接触,则A可以是 _____(选填编号)。
a.四氯化碳 b.汽油 c.乙醇
33.从皂化反应后的溶液中提取肥皂和甘油的过程如下:
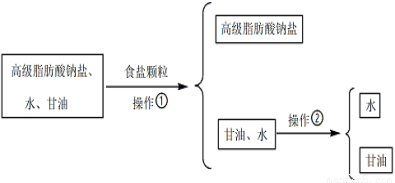
加入食盐颗粒后,液体表面析出白色固体,则食盐的作用是 。
操作②必须用到的玻璃仪器是_____(选填编号)。
a.漏斗 b.分液漏斗 c.蒸馏烧瓶
34.若甘油的产率明显低于高级脂肪酸钠盐的产率,可能的原因是_____(选填编号)。
a.油脂水解不充分 b.部分甘油挥发 c.甘油中混有水
实验二:测定油脂的碘值。碘值是指100g油脂中所能吸收(加成)碘的克数。
称取a g某油脂,加入含bmol I2的溶液(韦氏液),充分振荡;过量的I2用cmol/L Na2S2O3溶液滴定(以淀粉为指示剂):2Na2S2O3+ I2 →Na2S4O6+ 2NaI用去vmL。
35.配制韦氏液,溶剂选用冰醋酸而不选用水的原因是 。滴定终点时颜色的变化是 。
36.该油脂的碘值为(用相关字母表示) 。
37.冰醋酸也会消耗Na2S2O3,所以还要做相关实验进行校正,否则会引起测得的碘值偏_____(选填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:选择题
116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是

A.属第17族元素 B.属卤族元素
C.属非金属元素 D.有放射性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列物质的分子正负电荷重心不相重合的是
A.C2H2 B.CO2 C.NH3 D.BF3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省安康市高三上学期第二次教学质量调研化学试卷(解析版) 题型:选择题
A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴人沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如右图,下列推断正确的是

A.物质B是H2 B.物质C是Cl2 C.物质D是FeCl2 D.物质F是FeCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省安康市高三上学期第二次教学质量调研化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.H2、D2和T2互称为同位素,它们的化学性质几乎—样
B.二氧化碳、盐酸、氨水分别属于非电解质、强电解质、弱电解质
C.胶体和其它分散系的本质区别是丁达尔效应
D.硅是一种良好的半导体材料,可以制成计算机芯片和硅太阳能电池
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:填空题
(19分)
(1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知: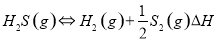 在恒容密闭容器中,控制不同温度进行H2S分解实验。
在恒容密闭容器中,控制不同温度进行H2S分解实验。
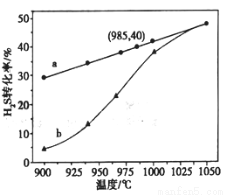
以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。 _____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
_____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
②电化学法
该法制氢过程的示意图如图。反应池中反应的离子方程式是___________________;
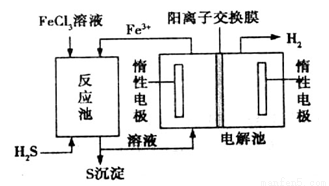
反应后的溶液进入电解池,电解总反应的离子方程式为________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式_______________________________________________。
②电池总反应的化学方程式_________________________________________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KmnO4溶液进行滴定,实验所得数据如下表所示;
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
①滴入最后一滴酸性KMnO4溶液,溶液__________________________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列物质不能通过化合反应得到的是
A.FeCl2 B.Fe(OH)3 C.H2SiO3 D.NaHSO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com