
【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、Mg0少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
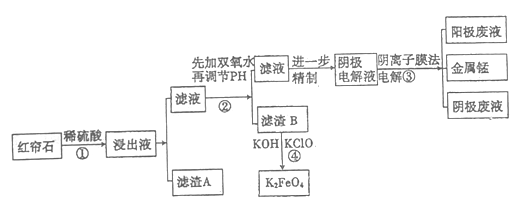
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_______________。
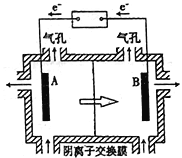
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;则与A电极连接的是直流电源的_____极。阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________。
【答案】 MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O Mn2+、Mg2+、Al3+ d b 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 负 2.24L
【解析】(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,该反应的离子方程式: MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O。
(2) 红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、Mg0少量MnO2等,加稀硫酸后发生反应,浸出液中的阳离子除H+、Fe2+、Fe3+外还有Mn2+、Mg2+、Al3+ 。
(3)步骤②中调节溶液的pH等于6,最好选用MnCO3,不会增加新杂质。根据表中所给数据,pH=6时,Fe3+、Al3+完全沉淀,所以滤渣B的成分为Fe(OH)3和Al(OH)3,除去Al(OH)3可加入 KOH溶液,使Al(OH)3溶解。本题答案:d b。
(4) 滤渣B含Fe(OH)3,被ClO氧化为FeO42,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(5)电解时,电解质溶液中阴离子移向阳极,所以电极B与直流电源的正极相连做阳极,则A电极与直流电源的负极相连做阴极;若阴极上只有锰单质析出,当生成11g锰为0.2mol时,Mn2+![]() Mn
Mn![]() 2e— 转移的电子数为0.4mol,阳极:4OH--4e—=O2↑+2H2O,产生的氧气为0.1mol,标况下体积为2.24L。答案:负 . 2.24L。
2e— 转移的电子数为0.4mol,阳极:4OH--4e—=O2↑+2H2O,产生的氧气为0.1mol,标况下体积为2.24L。答案:负 . 2.24L。


科目:高中化学 来源: 题型:
【题目】下列仪器为某些基本操作的部分仪器,请按照要求填空:
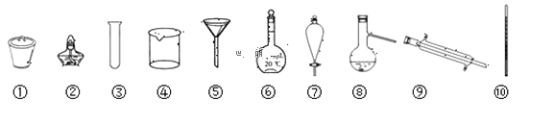
(1)写出仪器的名称:①________;⑦________;⑧________;
(2)上述仪器中,可以直接加热的仪器有________(填序号)。
(3)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃),需要上述仪器中的(填序号)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,稀释0.1 mol·L-1Na2CO3溶液,图中的纵坐标可以表示
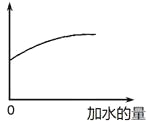
A. CO32-水解的平衡常数
B. 溶液的pH
C. 溶液中HCO3-的数目
D. 溶液中的c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
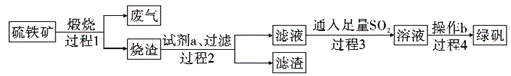
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
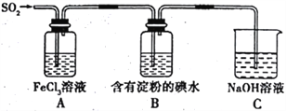
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
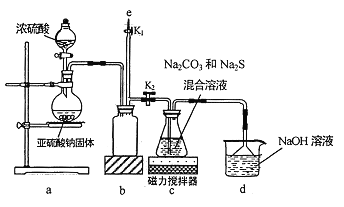
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯、硫、氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。
(1)氯气的颜色____________________。
(2)浓硫酸具有:①酸性,②强氧化性,③吸水性,④脱水性,下列各现象硫酸所表现出的性质为(填序号):
干燥氯气 ___________ ,使蔗糖变黑 ___________,
吸收氨气 ___________ ,与铜反应____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量
② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L 乙醇中含有碳原子数为2NA
B.6.0 g的SiO2固体含有0.1NA个SiO2分子
C.1L 0.5mol·L-1醋酸中含CH3COO-为0.5NA
D.12.0 g NaHSO4晶体中阴阳离子数为0.2 N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com