
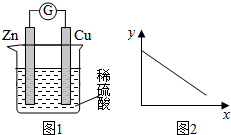
| A. | 铜棒的质量 | B. | c(Zn2+) | C. | c(H+) | D. | c(SO42-) |
分析 铜锌原电池中,Zn是负极,失去电子发生氧化反应,电极反应为Zn-2e-=Zn2+,Cu是正极,氢离子得电子发生还原反应,电极反应为2H++2e-=H2↑,据此解答.
解答 解:铜锌原电池中,Zn是负极,失去电子发生氧化反应,电极反应为Zn-2e-=Zn2+,Cu是正极,氢离子得电子发生还原反应,电极反应为 2H++2e-=H2↑,
A.Cu是正极,氢离子得电子发生还原反应,Cu棒的质量不变,故A错误;
B.由于Zn是负极,不断发生反应Zn-2e-=Zn2+,所以溶液中c(Zn2+)增大,故B错误;
C.由于反应不断消耗H+,所以溶液的c(H+)逐渐降低,故C正确;
D.SO42-不参加反应,其浓度不变,故D错误;
故选:C.
点评 考查原电池基本原理和溶液中离子浓度变化,掌握活泼金属锌为负极,铜为正极,锌和硫酸之间发生氧化还原反应是解答的关键,题目比较简单.


科目:高中化学 来源: 题型:多选题
| A. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | 等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 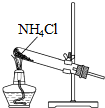 制取氨气 | B. | 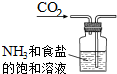 制取NaHCO3 | C. | 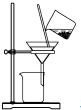 分离NaHCO3 | D. | 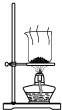 干燥NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥ | B. | ②③④⑤⑥ | C. | ②⑤⑥ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
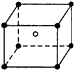
| A. | 1:8 | B. | 1:4 | C. | 1:2 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+2OH-→CO32-+H2O | B. | Al2O3+2OH-+3H2O→2[Al(OH)4]- | ||
| C. | 2Al+2OH-+6H2O→2[Al(OH)4]-+3H2↑ | D. | Al3++4OH-→[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
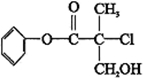
| A. | 有机物A 属于芳香烃 | |
| B. | 有机物A 可以与Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A 与浓硫酸混合加热,可以发生消去反应 | |
| D. | 1 mo1A 与足量的NaOH 溶液反应,最多可以消耗3mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有⑤ | C. | ③④⑤ | D. | 只有①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
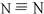 ,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式
,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com