
【题目】W溶液受热会发生分解反应。体积均为2L的4组溶液(忽略反应前后体积的变化),W的物质的量随时间的变化如表,则下列说法不正确的是( )
0min | 10min | 20min | 30min | 40min | 50min | 60min | ||
① | 10°C | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10°C | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25°C | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30°C | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A. 在10-20min内,实验①中W的平均分解速率为0.005molL-1min-1
B. a>1.1,且说明浓度越大,反应速率越快
C. 对比①和③,说明温度越高,反应速率越快
D. 对比①和④,不能说明同一时刻W的平均反应速率随温度升高而增大
【答案】C
【解析】
A、在10-20min内,实验①中W的物质的量的变化为0.1mol,所以在10-20min内,实验①中W的平均分解速率为![]() molL-1min-1=0.005molL-1min-1,故A正确;
molL-1min-1=0.005molL-1min-1,故A正确;
B、若a>1.1,由实验①、②可知,温度相同的条件下,浓度大先达平衡,所以a>1.1,且说明浓度越大反应速率越快,故B正确;
C、对比实验①和③,温度不同,起始的浓度也不同,所以对比实验①和③,不能说明W的平均反应速率随温度升高而增大,故C错误;
D、对比实验①和④,温度不同,起始的浓度也不同,所以对比实验①和④,不能说明同一时刻W的平均反应速率随温度升高而增大,故D正确;
故选:C。


科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36gcm-3.实验室制备少量1-溴丙烷的主要步骤如下:
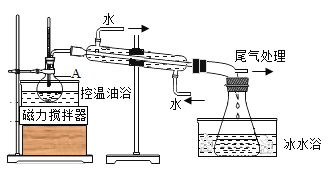
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24gNaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
(1)步骤1发生反应的方程式为______
(2)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(3)反应时生成的主要有机副产物有______。
(4)反应过程中可以观察到A的上方出现红棕色气体,其电子式为______。
(5)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是______。同时可以观察到的现象是______。
(6)步骤4中三次洗涤分别洗去的主要杂质是①______②______③______。
(5)步骤4中②的Na2CO3溶液还可以用下列哪个试剂代替______
A. NaOH溶液 B. NaI溶液 C. Na2SO3溶液 D. CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
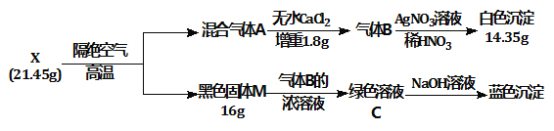
【题目】为探究绿色固体X(含四种元素)的组成和性质,设计并完成如下实验:
请回答:
(1) X的化学式是________。
(2) 绿色溶液C蒸干灼烧得到固体M,总反应的化学方程式是___________________________。
(3) 加热条件气体B能与氧气发生置换反应,写出该反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是__,其中氧化性最强的是___。
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下三个反应,请写出盐酸在三个反应中,分别起何种作用:
①Zn+2HCl=ZnCl2+H2↑__;
②2HCl![]() H2↑+Cl2↑__。
H2↑+Cl2↑__。
(3)化学实验中,如使其步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如图中:
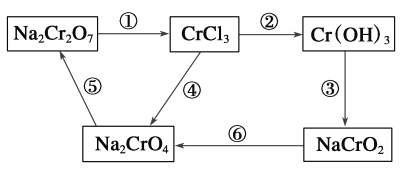
①在上述有编号的步骤中,需用还原剂的是__,需用氧化剂的是___。(填编号)
②完成步骤①的化学方程式,标出电子转移的方向和数目:
Na2Cr2O7+6KI+14HCl=2CrCl3+2NaCl+6KCl+3I2+___。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。
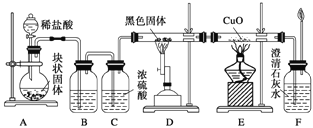
(1)写出装置A中发生反应的化学反应方程式:_______________________。
(2)装置B中最适宜的试剂是:_________________________。
(3)装置D中黑色固体为_____________(填名称),反应的化学方程式为:_____________________________。
(4)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是: ___________________________________。
(5)按照如图装置进行实验时,首先进行的操作名称是_____________。
(6)根据实验中的_________________现象,可证明CO具有还原性,有关反应的化学方程式是___________________________。
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的___________装置(填序号)。
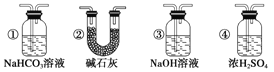
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是
A.FeS2![]() SO3
SO3![]() H2SO4
H2SO4
B.NaCl(aq)![]() Na
Na![]() Na2O2
Na2O2
C.Fe![]() FeSO4(aq)
FeSO4(aq)![]() Fe(OH)2
Fe(OH)2![]() Fe2O3
Fe2O3
D.Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() Fe
Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物B,俗名水杨酸,其结构简式为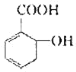 ,将B跟一种溶液C(足量)反应可得到一种钠盐(其化学式为C7H5O3Na),则C的化学式为_____,水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物中必定含有_____(填写除了羟基以外的官能团名称)。
,将B跟一种溶液C(足量)反应可得到一种钠盐(其化学式为C7H5O3Na),则C的化学式为_____,水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物中必定含有_____(填写除了羟基以外的官能团名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com