
��8�֣���X��Y����Ԫ����ɵ����ӻ�����A���ڿ����г�����յõ���XԪ�ص�16g����ɫ����B����������ʹƷ����ɫ������C����������ȫ��ͨ��������˫��ˮ�е�D��Һ������D��Һ�м���������BaCl2��Һ�����ˡ�ϴ�ӡ������93.2g���塣
��1��д��A�ĵ���ʽ ��
��2���ڴ˹����У�����5 mol/L��˫��ˮ���������Ϊ ��
��3����A����D��ϡ��Һ������E��������һ�ֵ��ʺ�һ�����壬��÷�Ӧ�Ļ�ѧ����ʽ ��
��4����������E��������������գ�ʹ��ֽ⣬���ɵ����ʵ�����B��C����һ�ֻ��������һ�ֻ�����Ļ�ѧʽ��_______��
(1) ��2�֣� (2) 80ml (2��)
��2�֣� (2) 80ml (2��)
(3)FeS2+H2SO4=H2S��+S��+FeSO4 (2��) (4) SO3 ��2�֣�
��������
�����������X��Y����Ԫ����ɵ����ӻ�����A���ڿ����г�����յõ���XԪ�ص�16g����ɫ����B������FeԪ�أ�n(Fe2O3)= 16g��160g/mol=0.1mol��n(Fe)=0.2mol����������ʹƷ����ɫ������C��������A�к���SԪ�أ�C��SO2����������SO2ȫ��ͨ��������˫��ˮ�е�D��Һ��D��H2SO4������D��Һ�м���������BaCl2��Һ�����ˡ�ϴ�ӡ������93.2g���塣n(BaSO4)= 93.2g��233g/mol=0.4mol����n(S)=0.4mol��n(Fe)��n(S)=1:2�����Ի�����A��ѧʽ��FeS2. ��1��A�ĵ���ʽ�� ����2������S�غ�ɵ�n(SO2)=0.4mol��SO2+H2O2=H2SO4.�ڴ˹����У�����˫��ˮ�����ʵ���Ҳ��0.4mol,��˫��ˮ��Ũ����5 mol/L�������������Ϊ0.4mol��5 mol/L=0.08L=80ml����3����A����D��ϡ��Һ������E��������һ�ֵ��ʺ�һ�����壬��÷�Ӧ�Ļ�ѧ����ʽ��FeS2+H2SO4=H2S��+S��+FeSO4����4����������������غ㶨�ɿ�֪������E��FeSO4�������������������գ�ʹ��ֽ⣬������Ӧ��2FeSO4
����2������S�غ�ɵ�n(SO2)=0.4mol��SO2+H2O2=H2SO4.�ڴ˹����У�����˫��ˮ�����ʵ���Ҳ��0.4mol,��˫��ˮ��Ũ����5 mol/L�������������Ϊ0.4mol��5 mol/L=0.08L=80ml����3����A����D��ϡ��Һ������E��������һ�ֵ��ʺ�һ�����壬��÷�Ӧ�Ļ�ѧ����ʽ��FeS2+H2SO4=H2S��+S��+FeSO4����4����������������غ㶨�ɿ�֪������E��FeSO4�������������������գ�ʹ��ֽ⣬������Ӧ��2FeSO4 Fe2O3+ SO2+SO3��һ�ֻ�����Ļ�ѧʽ��SO3��
Fe2O3+ SO2+SO3��һ�ֻ�����Ļ�ѧʽ��SO3��
���㣺�������ʵ��ƶϡ����ʵĵ���ʽ����ѧ��Ӧ����ʽ����д��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015��ӱ�ʡ��ˮ�и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����FeSO4��Fe2��SO4��3��H2SO4�Ļ����Һ������c��H+��=0.10mol/L��ȡ����Һ200mL���������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����27.96g������ȡ�û����Һ200mL�������м������NaOH��Һ������ʹ���ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������ù��壬���յù���8.00g����ԭ�����Һ��c��Fe2+����c��Fe3+��֮��Ϊ��������
A��4��1 B��3��1 C��2��1 D��1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ӱ�ʡʯ��ׯ����У����������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A��ͬ����Ԫ�صĵ��ʴ��ϵ��£��۵�����
B��Ԫ�ص���������ϼ�����ֵ�ϵ��������ڵ�������
C��ͬ��������Ԫ�ص�ԭ�Ӱ뾶ԽС��Խ��ʧȥ����
D��Ԫ�صķǽ�����Խǿ��������̬�⻯��ˮ��Һ������Խǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ӱ�ʡ��ɽ�и���10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣�����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
������ | ��̿���ڸ��������»�ԭCuO |
������ | ��ⷨ��2Cu��H2O |
������ | ���£�N2H4����ԭ����Cu(OH)2 |
��1����ҵ�ϳ��÷�����ͷ�������ȡCu2O�������÷�������ԭ���Ƿ�Ӧ���������ƣ������²��������� ��ʹCu2O���ʽ��͡�
��2����֪����C(s)+O2(g)=CO2(g) ��H=akJ��mol��1��
��2CO(g)+O2(g)=2CO2(g) ��H=bkJ��mol��1��
��2Cu2O(s)+O2(g)=4CuO(s) ��H=ckJ��mol��1.
�������Ʊ����̻�����ж����壬д���Ʊ���Ӧ���Ȼ�ѧ����ʽ ��
��3��������������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ���õ�ص���������Cu2O��ӦʽΪ ��
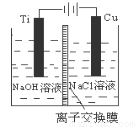
��4��������Ϊ������������Һ̬�£�N2H4����ԭ����Cu(OH)2���Ʊ�����Cu2O��ͬʱ�ų�N2�����Ʒ��Ļ�ѧ����ʽΪ ��
��5������������ü�ȩϡ��Һ����£�����Ӧ�¶Ƚϸ߶�ʹ���ֲ�Ʒ�������� ����������ƣ��ɷ�������������Cu2O��
��6������ͬ���ܱ������У��÷�����ͷ������Ƶõ�Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺
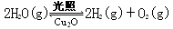 �SH >0
�SH >0
ˮ������Ũ�ȣ�mol��L��1����ʱ��t (min)�仯���±���
��� | �¶� | 0 | 10 | 20 | 30 | 40 | 50 |
�� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
�� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
�� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
�����жϣ�ʵ��ٵ�ǰ20 min��ƽ����Ӧ���� ��(O2)�� ��ʵ���¶�T1 T2���>������<�����������Ĵ�Ч�ʣ�ʵ��� ʵ��ڣ��>������<������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ӱ�ʡ��ɽ�и���10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з����������ȷ���ܴﵽԤ��Ŀ�ĵ��ǣ�
��� | ʵ��Ŀ�� | ���������� |
�� | �Ƚ�ˮ���Ҵ����ǻ���Ļ�����ǿ�� | �ý����Ʒֱ���ˮ���Ҵ���Ӧ |
�� | ��֤��CH2=CHCHO�к���̼̼˫�� | ����KMnO4������Һ�����Ϻ�ɫ�Ƿ���ȥ |
�� | ֤����������ijЩ������Һ�����·������� | ������Һ�м��뱥������ͭ��Һ���г����������ٰѳ�����������ˮ�� |
�� | �����������е���Ԫ�� | ��������������NaOH��Һ��Ϲ��ȣ���ַ�Ӧ����ȴ������Һ�м�ϡHNO3�ữ���ٵμ�AgNO3��Һ |
�� | �жϲ�ͬ��Ӧ�ķ�Ӧ���ʵĴ�С | �Ƚϲ�ͬ��Ӧ�ķ�Ӧ�����ݵĴ�С |
A���٢ڢ� B���ڢۢ� C���٢ۢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ��ɫ��У������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йصļ����������ȷ���ǣ� ��
A��.�ڷ�Ӧ3Cu��8HNO3(ϡ)===3Cu(NO3)2��2NO����4H2O�У�����1 molͭ������ʱ������ԭ������Ϊ mol
mol
B��ij��Һ100 mL�����к�����0.03 mol������0.04 mol�����ڸ���Һ��Ͷ��1.92 gͭ���ȣ���Ӧ��ų�һ����������ԼΪ0.015 mol
C������ʱ�����ݻ�Ϊa mL���Թ��г���NO2���壬Ȼ������ˮ�е�����ˮ�治������ʱΪֹ����ͨ��b mL O2�������Һ���ּ�������������Թ������ʣ������Ϊc mL���Ҹ����岻��֧��ȼ�ա���a��b�Ĺ�ϵΪ��a��4b��3c
D�����ʵ���֮��Ϊ2��5��п��ϡ���ᷴӦ�������ᱻ��ԭ�IJ���ΪN2O����Ӧ������пû��ʣ�࣬��÷�Ӧ�б���ԭ��������δ����ԭ����������ʵ���֮��Ϊ1��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ��ɫ��У������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ����ʵ������ƽ���ƶ�ԭ�����͵��ǣ� ��
c(����) / (mol��L-1) | 0.1 | 0.01 |
pH | 2.9 | 3.4 |




�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ��ѧ�ڸ�����һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���0.2mol/LAl2(SO4)3����Һ�У���μ���1.0mol/LNaOH��Һ��ʵ������ҺpH��NaOH��Һ����仯��������ͼ�������й�˵����ȷ���ǣ� ��
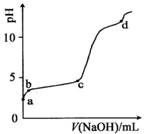
A��a��ʱ����Һ�����Ե�ԭ����Al3+ˮ�⣬���ӷ���ʽΪ��Al3��+3OH- Al(OH)3
Al(OH)3
B��d��ʱ��Al(OH)3������ʼ�ܽ�
C��a-b�Σ���ҺpH����A13+Ũ�Ȳ���
D��b-c�Σ������OH-��Ҫ��������AI(OH)3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����и����ڶ���ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ��ֻ���ܺ������������еļ���(��������Һ�к��Ľ��ٵ�H����OH��)��Na����NH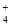 ��SO
��SO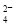 ��CO
��CO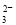 ��NO
��NO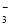 ��ȡ200 mL����Һ����Ϊ����������ݷֱ�������ʵ�顣ʵ��1����һ�ݼ����������ռ���ȣ������������ڱ�״����Ϊ224 mL��ʵ��2���ڶ����ȼ������������ᣬ�������ټ���������BaCl2��Һ���ù���2.33 g������˵����ȷ����
��ȡ200 mL����Һ����Ϊ����������ݷֱ�������ʵ�顣ʵ��1����һ�ݼ����������ռ���ȣ������������ڱ�״����Ϊ224 mL��ʵ��2���ڶ����ȼ������������ᣬ�������ټ���������BaCl2��Һ���ù���2.33 g������˵����ȷ����
A������Һ��һ������Na������c(Na��)��0.1 mol��L��1
B������Һ�п��ܺ���Na��
C������Һ��һ������NO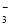
D������Һ�п϶�����NH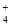 ��SO
��SO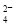 ��CO
��CO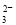 ��NO
��NO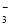
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com