
分析 (1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变;
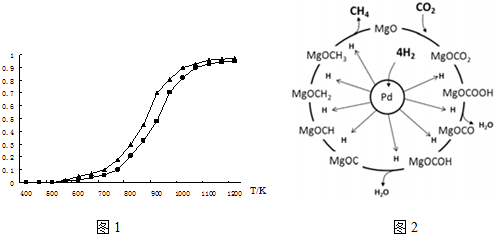
(2)①根据图示可以看出,CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0;
(3)根据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”结合反应机理来书写方程式并结合化合价判断;
(4)Ksp(CaCO3)=c(Ca2+)•c(CO32-),Ksp(CaSO4)=c(Ca2+)•c(SO42-),根据溶度积常数来计算.
解答 解:(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,故答案为:+247kJ/mol;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,故答案为:该反应△H>0,△S>0,高温时△G=△H-T△S<0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2=CH4+2H2O;反应过程中碳元素的化合价为-2价的中间体是MgOCH2;
故答案为:CO2+4H2=CH4+2H2O;MgOCH2;
(4)达到平衡后,Ksp(CaCO3)=c(Ca2+)•c(CO32-),Ksp(CaSO4)=c(Ca2+)•c(SO42-),在$\frac{c(C{{O}_{3}}^{2-})}{c(S{{O}_{4}}^{2-})}$分子和分母同乘以钙离子的浓度,所以溶液中$\frac{c(C{{O}_{3}}^{2-})}{c(S{{O}_{4}}^{2-})}$=$\frac{Ksp(CaC{O}_{3})}{Ksp(CaS{O}_{4})}$,
故答案为:$\frac{Ksp(CaC{O}_{3})}{Ksp(CaS{O}_{4})}$.
点评 本题涉及反应的方向判断、盖斯定律的应用以及沉淀溶解平衡常数的计算知识,属于综合知识的考查,难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2的溶解度最小 | B. | Ca(OH)2的溶解度最小 | ||
| C. | AgCl的溶解度最小 | D. | 相同条件下Ksp越小的溶解度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
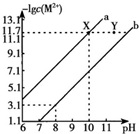 25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )
25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )| A. | b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1 | |
| B. | 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中C(Fe2+):C(Cu2+)=1:104.6 | |
| C. | 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 | |
| D. | 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 2min末浓度/(mol•L-1) | 0.08 | a | b |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | 2min时Y的物质的量为0.14 | |
| C. | 增大平衡后的体系压强,v(正)增大,v(逆)减小 | |
| D. | 2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.045 mol/L | B. | 1 mol/L | C. | 0.5 mol/L | D. | 2.24mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
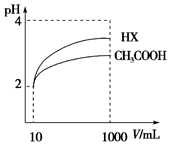 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com