
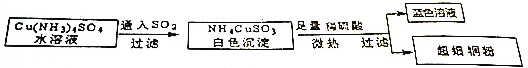
| A. | SO2在此过程中作氧化剂 | |
| B. | 超细铜粉能导电,所以超细铜粉是电解质 | |
| C. | 工业上常用电解法冶炼铜 | |
| D. | 理论上制得1mol铜粉,共转移3mole- |
分析 A.Cu(NH3)4SO4溶液与SO2反应生成+1价Cu,Cu元素的化合价降低,则S元素的化合价升高;
B.单质不是电解质;
C.冶炼较不活泼的金属用热还原法;
D.Cu(NH3)4SO4溶液与SO2反应生成Cu+,Cu+与氢离子反应生成Cu和Cu2+.
解答 解:A.Cu(NH3)4SO4溶液与SO2反应生成+1价Cu,Cu元素的化合价降低,则S元素的化合价升高,则SO2在反应被氧化,作还原剂,故A错误;
B.铜属于金属单质,存在自由移动的电子能导电,单质不是电解质,所以Cu不是电解质,故B错误;
C.Cu元素的活泼性较弱,冶炼较不活泼的金属用热还原法,所以冶炼Cu用热还原法,故C错误;
D.2molCu(NH3)4SO4反应失去2mol电子与SO2反应生成2molCu+,2molCu+与氢离子反应生成1molCu和1molCu2+,转移1mol电子,所以制得1mol铜粉,共转移3mole-,故D正确.
故选D.
点评 本题考查了铜的化合物的性质、氧化还原反应、金属的冶炼方法等,题目涉及的知识点较多,题目难度中等,侧重于考查学生对基础知识的综合应用能力,注意把握电子守恒在氧化还原反应计算中的应用.


科目:高中化学 来源: 题型:解答题
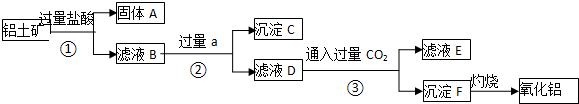
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
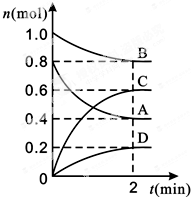 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
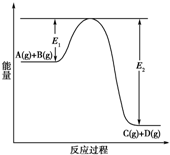 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 根据纤维在火焰上燃烧产生的气味,可确定该纤维是否为蛋白质纤维 | |
| C. | 两份常温下均为饱和溶液(一份是NaOH溶液,一份是氢氧化钙溶液),上述两份饱和溶液可通过加入少量的NaOH固体而鉴别出 | |
| D. | 某矿石中加入足量的盐酸,根据放出的二氧化碳气体,可证明该矿石一定含有碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
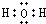 和
和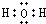 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com