
 海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案:
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案:分析 海水中其中70%为氯化钠,另外还含有氯化镁、硫酸镁等,要得到较纯净的NaCl,应该除去海水中的Mg2+、SO42-,Mg2+用NaOH溶液除去,生成Mg(OH)2沉淀,SO42-用BaCl2溶液除去,生成BaSO4沉淀,因为加入的氯化钡溶液过量,用Na2CO3除去BaCl2,用适量稀盐酸除去过量的碳酸钠,过滤后得到NaCl溶液,最后蒸发浓缩、冷却结晶得到NaCl晶体;所以该流程图中A为NaOH、BaCl2溶液,B为Na2CO3溶液、C为稀盐酸,
结合题目分析解答.
解答 解:海水中其中70%为氯化钠,另外还含有氯化镁、硫酸镁等,要得到较纯净的NaCl,应该除去海水中的Mg2+、SO42-,Mg2+用NaOH溶液除去,生成Mg(OH)2沉淀,SO42-用BaCl2溶液除去,生成BaSO4沉淀,因为加入的氯化钡溶液过量,用Na2CO3除去BaCl2,用适量稀盐酸除去过量的碳酸钠,过滤后得到NaCl溶液,最后蒸发浓缩、冷却结晶得到NaCl晶体;
所以该流程图中A为NaOH、BaCl2溶液或,Ba(OH)2 溶液,B为Na2CO3溶液、C为稀盐酸,
(1)步骤Ⅰ中除去镁离子和硫酸根离子,分别生成氢氧化镁、硫酸钡沉淀,发生反应的离子方程式是Mg2++2OH-=Mg(OH)2↓、Ba2++SO42-=BaSO4↓,加入过量A的目的是使Mg2+和SO42-全部转化为沉淀而除去,
故答案为:NaOH、BaCl2溶液或Ba(OH)2溶液;使Mg2+和SO42-全部转化为沉淀而除去;
(2)步骤Ⅱ中试剂目的是除去过量的氯化钡,B为Na2CO3,
故答案为:Na2CO3;使Ba2+全部转化为碳酸钡沉淀除去;
(3)步骤Ⅲ中试剂目的是除去过量的碳酸钠和过量的氢氧根离子且不能引进新的杂质,C为稀盐酸,加入适量的C至无气体产生,
故答案为:盐酸;无气体产生;除去过量的CO32-和OH-;
(4)步骤Ⅳ的实验操作为蒸发,
故答案为:蒸发;
①a为玻璃棒、b是蒸发皿、c是酒精灯,
故答案为:a为玻璃棒、b是蒸发皿、c是酒精灯;
②仪器a是玻璃棒,起搅拌作用,防止局部温度过高而溅出液体,从而易产生安全事故,
故答案为:搅拌;防止溶液局部温度过高而溅出液体;
③当仪器b中出现大量固体时即可停止加热,利用余热将溶液蒸干,
故答案为:大量固体.
点评 本题考查海水资源综合利用,为高频考点,涉及物质分离和提纯及除杂、蒸发等知识点,明确实验原理、物质性质是解本题关键,注意除杂时不能引进新的杂质,如果引进新的杂质在最终过程中能除去,题目难度中等.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 严格执行机动车尾气排放标准有利于防止大气污染 | |
| B. | 使用二氧化硫增白的食品对人体健康产生损害 | |
| C. | 使用氯气对自来水消毒时生成的有机氯化物可能对人体有害 | |
| D. | 食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
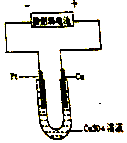 肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的分子个数比为17:16 | B. | 它们的原子个数比为17:16 | ||
| C. | 它们的体积比为17:16 | D. | 它们密度比为16:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 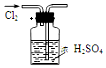 干燥Cl2 | B. |  吸收HCl | ||
| C. |  用自来水制蒸馏水 | D. |  吸收NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物一定是酸性氧化物 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 分子中含有几个氢原子就是几元酸 | |
| D. | 酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pt是正极 | B. | 负极反应:Zn-2e-═Zn2+ | ||
| C. | 正极反应:2H++2e-═H2↑ | D. | 正极反应:2H2O+O2+4e-═4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com