
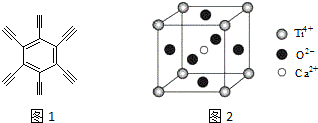
分析 (1)钛是22号元素,Ti2+核外有20个电子,写出其基态核外电子排布,然后判断其基态价电子;
(2)利用六乙炔苯分子中C的成键来分析碳原子的杂化类型;1六乙炔苯分子含有1个碳氢σ键,2个碳氧σ键,共有3个σ键;
(3)六乙炔苯是非极性分子,甲醛分子与水分子之间可以形成氢键,氢键的存在能够大大增强物质的溶解性;
(4)六乙炔苯与苯结构相似的分子晶体,相对分子量越大熔沸点高;
(5)利用均摊法确定化学式,处于晶胞中心的原子被一个晶胞占有,处于顶点上的原子被8个晶胞占有,处于面上的原子被2个晶胞占有,处于棱上的原子被4个晶胞占有,据此解答.
解答 解:(1)钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布为:1s22s22p63s23p63d2,所以基态价电子排布式为3d2;
故答案为:3d2;
(2)六乙炔苯分子中苯环上的碳原子是sp2,而侧链上的碳原子是sp,则碳原子轨道的杂化类型为sp、sp2杂化;1个六乙炔苯分子含有1个碳氢σ键,2个碳氧σ键,共有3个σ键,所以1mol1mol六乙炔苯分子中含有σ键的数目为3mol;
答案为:sp、sp2;3mol或24×3.02×1023;
(3)六乙炔苯是非极性分子,甲醛分子与水分子之间可以形成氢键,氢键的存在能够大大增强物质的溶解性,故答案为:甲醛与水分子之间形成氢键;
(4)六乙炔苯与苯结构相似的分子晶体,相对分子量越大熔沸点高,六乙炔苯的相对分子量比苯的相对分子量大,所以六乙炔苯的沸点比苯的沸点高,故答案为:前者相对分子质量大,分子间作用力(或范德华力)大,熔沸点高;
(5)利用均摊法确定化学式,处于晶胞中心的原子被一个晶胞占有,处于面上的原子被2个晶胞占有,处于顶点上的原子被8个晶胞占有,处于棱上的原子被4个晶胞占有,钛原子的个数为8×$\frac{1}{8}$=1,氧原子的个数为6×$\frac{1}{2}$=3个,钙离子处于晶胞中心,被一个晶胞占有,所以Ca2+个数为1,则该化合物的化学式为CaTiO3,
故答案为:CaTiO3.
点评 本题考查了基态价电子排布式、轨道杂化类型的判断、等电子体判断、依据晶胞结构书写物质化学式,题目难度中等,掌握基础是解题关键,注意等电子体的概念、注意利用均摊法确定化学式的方法.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
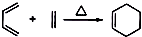 ,
,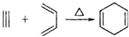 叫狄尔斯阿德而反应,用于构建六元环状烃,则下列说法不正确的是( )
叫狄尔斯阿德而反应,用于构建六元环状烃,则下列说法不正确的是( )| A. | 上述信息中反应的产物都可以使酸性高锰酸钾溶液褪色 | |
| B. | 通过上述反应合成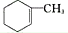 ,所需反应物为 2-甲基-1,3-丁二烯和乙烯 ,所需反应物为 2-甲基-1,3-丁二烯和乙烯 | |
| C. | 2-甲基-1,3-丁二烯和丙烯发生上述反应产物只有一种 | |
| D. | 2mol 环戊二烯发生上述反应的方程式为: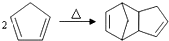 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 气体发生装置 |  a | 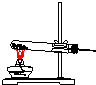 b |  c |
| 气体收集装置 |  ① |  ② |  ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl | |
| B. | CH2=CH2+HOCl$\stackrel{催化剂}{→}$HOCH2-CH2Cl | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | 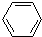 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ -Br+HBr -Br+HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
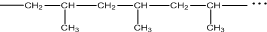 合成该高分子化合物的单体是( )
合成该高分子化合物的单体是( )| A. | CH2=CH2 | B. | CH2=CH-CH3 | C. | CH3CH2CH3 | D. | CH3CH(CH3)CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com