
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如右图所示。下列说法正确的是( )

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为Ni(OH)2+OH--e-=NiO(OH)+H2O
C.充电时,电池的甲电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
【答案】D
【解析】
开关连接用电器时,应为原电池原理,甲电极为负极,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-=2H2O,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-;开关连接充电器时,为电解池,充电与放电过程相反,据此解答。
A.放电时,该电池为原电池,电解质溶液中阴离子向负极移动,所以OH-向负极甲电极移动,A错误;
B.放电时,乙电极为正极,得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-,B错误;
C.放电时,氢气在碳电极发生氧化反应,碳电极作负极;充电时,碳电极发生还原反应,作阴极,应与电源的负极相连,C错误;
D.放电时,正极电极反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH-,负极电极反应式为:H2+2OH--2e-=2H2O,两式相加得总反应:H2+2NiOOH![]() 2Ni(OH)2,D正确;
2Ni(OH)2,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe(OH)SO4]n能用做净水剂(絮凝剂),可由绿矾(FeSO47H2O)和KClO3在水溶液中反应得到。下列说法不正确的是( )
A.KClO3作氧化剂,每生成1mol[Fe(OH)SO4]n消耗![]() molKClO3
molKClO3
B.生成聚合硫酸铁后,水溶液的pH增大
C.聚合硫酸铁可在水溶液中水解生成氢氧化铁胶体而净水
D.在反应中氧化剂和还原剂物质的量之比为1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
①CS2为V形的极性分子
②ClO3-的空间构型为平面三角形
③SF6中有6对完全相同的成键电子对
④SiF4和SO32-的中心原子均为sp3杂化
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
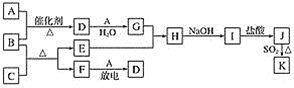
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素形成的单质在环境、生命活动、生产、科研等方面有重要作用。
(1)氟利昂在紫外线的作用下能产生氯原子,氯原子对臭氧层有破坏作用。氯原子对臭氧层的破坏作用可用如下过程表示:Cl+O3![]() ClO+O2、O3
ClO+O2、O3![]() O2+O、ClO+O
O2+O、ClO+O![]() Cl+O2。这一过程总的化学方程式是______________________________。根据总反应的化学方程式,可知氯原子在反应中作________________________。
Cl+O2。这一过程总的化学方程式是______________________________。根据总反应的化学方程式,可知氯原子在反应中作________________________。
(2)意大利科学家使用普通氧分子和带正电的氧离子制出了新型的氧分子O4,它可能具有与S4相似的长方形结构。O4的摩尔质量为______;相同质量的O2、O3、O4的分子数之比为______,原子数之比为______;下列有关O4的说法不正确的是______(填序号)。
A.题述中生成O4的反应不属于化学变化
B.O4与O2、O3都是氧的同素异形体
C.O2可能具有很强的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸟粪石[化学式为Mg(NH4)PO4·6H2O]是一种盛产于秘鲁的优质氮磷肥料;钴(Co)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是
①钴不是主族元素;②![]() Cl2不能长期稳定地存在;③Mg的原子结构示意图为
Cl2不能长期稳定地存在;③Mg的原子结构示意图为 ;④鸟粪石中两种阳离子为Mg2+、NH4+
;④鸟粪石中两种阳离子为Mg2+、NH4+
A.①②③④B.仅①②④C.仅②③④D.仅①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉积物微生物燃料电池可处理含硫废水,其工作原理如图所示。下列说法错误的是( )
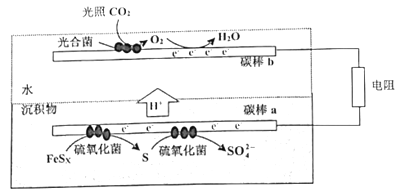
A. 碳棒b的电极反应式为:O2+4e-+4H+=2H2O
B. 光照强度对电池的输出功率有影响
C. 外电路的电流方向:碳棒a→碳棒b
D. 酸性增强不利于菌落存活,故工作一段时间后,电池效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KClO3也可采用“电解法”制备,装置如图所示。
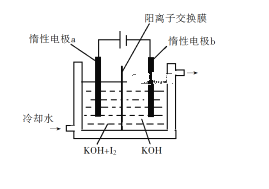
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有__________(写出一点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com