
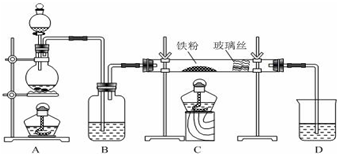
 ,分子式为C6H8O6;其中的-OH叫羟基(填官能团名称).在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C有还原性(填氧化性或还原性).
,分子式为C6H8O6;其中的-OH叫羟基(填官能团名称).在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C有还原性(填氧化性或还原性). 科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
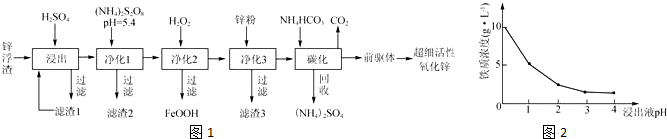
 已知乙酸和乙醇在浓硫酸催化下会发生下列反应:
已知乙酸和乙醇在浓硫酸催化下会发生下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,混合溶液中当c(H+)=$\sqrt{{k}_{W}}$ mol•L-1时可判定该溶液呈中性 | |
| B. | pH=5的H2SO4溶液,加水稀释到500倍,则稀释后c(H+)与c(SO42-)的比为2:1 | |
| C. | 某温度下,水的离子积常数Kw=10-12,该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为9:1 | |
| D. | 将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为11:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的元素是氯元素 | |
| B. | 氧化产物与还原产物的物质的量之比为l:1 | |
| C. | 消耗l mol还原剂,转移5 mol电子 | |
| D. | 净化1 L含CN-1.04 mg•L-1的废水,理论上需用2×l0-5mol C1O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3═2Fe3++3SO42- | B. | KClO3═K++Cl-+O32- | ||
| C. | KAl(SO4)2═K++Al3++2SO42- | D. | NaHSO4═Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止铁生锈,在其表面涂一层防锈油漆 | |
| B. | 为防止火灾,在面粉厂、加油站等场所要严禁烟火 | |
| C. | 为加快KClO3的分解速率,加入MnO2 | |
| D. | 为提高H2O2的分解率,向溶液中滴加FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
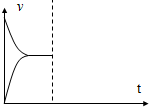 在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.
在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com