
可逆反应aA(g)+bB(g) cC(g)+dD(g)符合下图。则下列叙述正确的是
cC(g)+dD(g)符合下图。则下列叙述正确的是

| A.a+b>c+d;正反应放热 |
| B.a+b<c+d;正反应吸热 |
| C.a+b<c+d;正反应放热 |
| D.a+b>c+d;正反应吸热 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
下图是可逆反应A+2B  2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断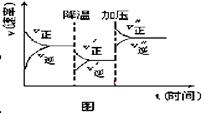
A.正反应是吸热反应
B.若A、B是气体,则D是液体或固体
C.D可能是气体.
D.A、B、C、D均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将气体A、B置于容积为2L的密闭容器中,发生如下反应:
4A(g)+B(g)=2C(g)
反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol。则:
用反应物A浓度的减少来表示该反应的速率应为
用反应物B浓度的减少来表示该反应的速率应为
用生成物C浓度的增加来表示该反应的速率应为
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是( )
| A.凡是放热反应都是自发的,由于吸热反应都是非自发的 |
| B.自发反应在恰当条件下才能实现 |
| C.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
| D.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,密闭容器中发生反应aX(g)  bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
| A.可逆反应的化学计量数:a>b+c |
| B.压缩容器的容积时,v(正)增大,v(逆)减小 |
| C.达到新平衡时,物质X的转化率减小 |
| D.达到新平衡时,混合物中Z的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在1 000 K时,已知反应Ni(s)+H2O(g)  NiO(s)+H2(g)的平衡常数K=0.059,当水蒸气和氢气的物质的量浓度相等时,此反应
NiO(s)+H2(g)的平衡常数K=0.059,当水蒸气和氢气的物质的量浓度相等时,此反应
| A.已达平衡状态 | B.未达平衡状态,反应正向进行 |
| C.未达平衡状态,反应逆向进行 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+ H2O(g)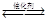 CO2(g) + H2(g) △H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g) + H2(g) △H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
| A.增加压强 | B.降低温度 | C.增大CO 的浓度 | D.更换催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时数据如下表:
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | | |
| | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能用化学平衡原理解释的是
| A.温度控制在500℃有利于合成氨反应 |
| B.用排饱和食盐水法收集Cl2 |
| C.打开碳酸饮料会有大量气泡冒出 |
| D.在硫酸工业生产中使用过量的氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com