
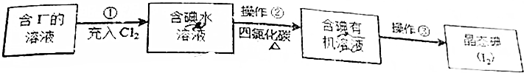
分析 含I-废水冲入氯气,发生氧化还原反应生成I2,加入四氯化碳,发生萃取,然后进行蒸馏,可得到碘,
(1)操作②为有机物和碘的分离,可蒸馏;
(2)碘易溶于四氯化碳;
(3)实验室用浓盐酸和二氧化锰在加热条件下制备氯气,氯气、碘在水溶液中发生氧化还原反应生成碘酸和HCl;
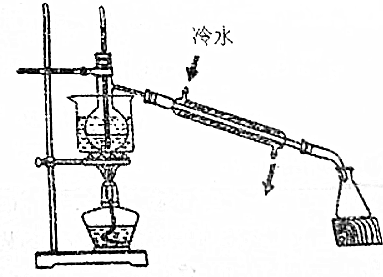
(4)蒸馏时,温度计用于测量馏分的温度,为充分冷凝,水应从下端进.
解答 解:含I-废水冲入氯气,发生氧化还原反应生成I2,加入四氯化碳,发生萃取,然后进行蒸馏,可得到碘,
(1)操作②为有机物和碘的分离,一般用蒸馏的方法,故答案为:蒸馏;
(2)碘易溶于四氯化碳,为便于振荡,加入CCl4小于10mL,故答案为:<;碘易溶于四氯化碳;
(3)实验室用浓盐酸和二氧化锰在加热条件下制备氯气,反应的离子方程式为MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,氯气、碘在水溶液中发生氧化还原反应生成碘酸和HCl,反应方程式为5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;5Cl2+I2+6H2O=2HIO3+10HCl;
(4)水浴加热,可使物质受热均匀,温度计控制的不是混合液的温度,不能插到液体中,水银球应该放在支管口处,冷凝管的使用原则是下口进水口,上口是出水口,
故答案为:受热均匀;温度计插到了液体中、冷凝管进出水的方向颠倒.
点评 本题主要考查物质的分离和提纯等试验基本操作,侧重于学生的分析、实验能力的考查,注意蒸馏操作是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水时,冷却水应从冷凝管的上端进入 | |
| B. | 分液时,应把下层液体从下端放出后,再把上层液体从下端放出 | |
| C. | 过滤时,漏斗的下端应紧贴烧杯内壁 | |
| D. | 萃取时,所选的萃取剂的密度应比原溶液的密度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.
非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂的物质的量之比为1:14 | |
| B. | Cl2是该反应的氧化产物 | |
| C. | 当转移0.2mol电子时,被氧化的还原剂的物质的量为0.2mol | |
| D. | 由此反应可知还原性HCl>CrCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:5 | B. | 5:3 | C. | 5:6 | D. | 6:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中加入氢氧化钠溶液,先有白出现,后白色沉淀逐渐消失 | |
| B. | 将铜片放人氯化铁溶液,钢片表面生成银白色的铁 | |
| C. | 在氯化铁溶液中滴入氢氧化钠溶液,有红褐色沉淀出现 | |
| D. | 将铜粉加人冷的浓硝酸中会发生钝化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com