
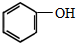
 (制酚醛树脂)
(制酚醛树脂) 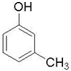 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )分析 (1)醛类物质含有醛基;
(2)同分异构体是分子式相同,结构不同的物质互为同分异构体;
(3)同系物是指结构相似,组成上相差CH2原子团的物质互称同系物;
(4)选同时包含两个双键的碳链做主链.
解答 解:(1)HCHO含有醛基,属于醛类,故答案为:⑥;
(2)①CH3COOH(调味剂) ②HCOOCH3(烟草熏蒸剂)分子式相同,结构不同,互为同分异构体,故答案为:②;
(3)③ (制酚醛树脂) ④
(制酚醛树脂) ④ (生产杀虫剂)结构相似,组成上相差1个CH2原子团,互称同系物,故答案为:④;
(生产杀虫剂)结构相似,组成上相差1个CH2原子团,互称同系物,故答案为:④;
(4)选同时包含两个双键的碳链做主链,名称为:1,3-丁二烯,故答案为:1,3-丁二烯.
点评 本题考查有机物的官能团及其结构和同系物、同分异构体的概念分析判断,难度不大,注意把握有机物的结构特点和官能团的结构和性质,学习中注意把握有机物的类别和性质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
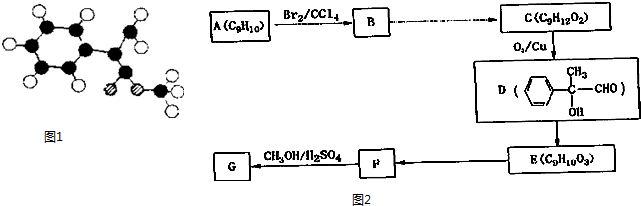
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.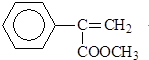 .
.
 .
.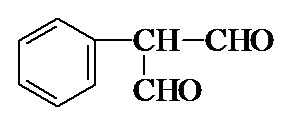 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大H2O2的浓度 | B. | 加入少量MnO2粉末 | ||
| C. | 加入几滴FeCl3溶液 | D. | 把盛有H2O2溶液的试管放在冰水里 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
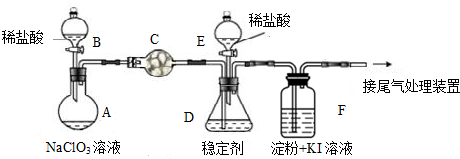
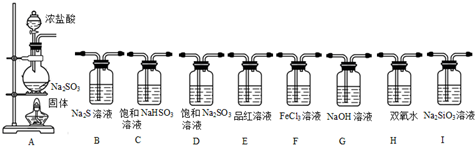
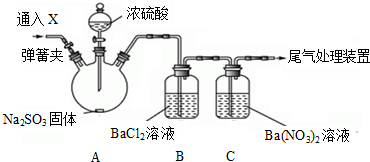

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,14 g乙烯中含碳原子数为NA | |
| B. | 1 mol NH4+与1 mol OH-所含的电子数均为10NA | |
| C. | 常温常压下,22.4L CH4中含C-H键数目为4NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com