
分析 (1)反应前后气体的体积比为3:4,结合m=nM、n=$\frac{V}{Vm}$计算;
(2)测得生成物的体积是448mL,密度是2.41g•L-1,则生成物的物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,生成气体的总质量为0.448L×2.41g/L=1.08g,结合反应可知XOY的物质的量为0.01mol,质量为1.08g-0.02mol×$\frac{3}{4}$×32g/mol=1.08g-0.48g=0.6g,结合M=$\frac{m}{n}$计算;
(3)结合V=$\frac{m}{ρ}$计算;
(4)结合(2)可知XOY的相对分子质量,再结合X、Y两元素的质量之比为3:8计算.
解答 解:(1)反应前后气体的体积比为3:4,氧气的体积为448mL×$\frac{3}{4}$=336mL,氧气的质量m=$\frac{0.336L}{22.4L/mol}$×32g/mol=0.48g,
故答案为:336mL;0.48g;
(2)测得生成物的体积是448mL,密度是2.41g•L-1,则生成物的物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,生成气体的总质量为0.448L×2.41g/L=1.08g,结合反应可知XOY的物质的量为0.01mol,质量为1.08g-0.02mol×$\frac{3}{4}$×32g/mol=1.08g-0.48g=0.6g,则化合物XOY的摩尔质量是M=$\frac{m}{n}$=$\frac{0.6g}{0.01mol}$=60g/mol,
故答案为:60g/mol;
(3)XOY(液态)密度为1.25g•cm-3,由V=$\frac{m}{ρ}$可知,参加反应的XOY体积为$\frac{0.6g}{1.25g/c{m}^{3}}$=0.48mL,故答案为:0.48;
(4)XOY的相对分子质量为60,则X、Y的相对原子质量之和为60-16=42,设X的相对原子质量为x,由X、Y两元素的质量之比为3:8,则x:(42-x)=3:8,解得x=12,则Y的相对原子质量为42-12=32,可知X为C,Y为S,
故答案为:C;S.
点评 本题考查物质的量的计算,为高频考点,把握反应中物质的量的关系、物质的量的基本计算公式等为解答的关键,侧重分析与计算能力的考查,注意元素质量比与相对原子质量比的关系,题目难度不大.


科目:高中化学 来源: 题型:推断题
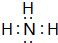 ,A和D按原子数1:1形成的化合物的结构式为H-O-O-H.
,A和D按原子数1:1形成的化合物的结构式为H-O-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和O3 | B. | ${\;}_{17}^{35}Cl$和${\;}_{17}^{37}Cl$ | ||
| C. | CH3CH2CH2CH3和  | D. | C2H6和C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LCH4中含有氢原子数目为4NA | |
| B. | 1 molNa2O2中含有的阴离子和阳离子的数目为2NA | |
| C. | 0.1 mol/LCu(NO3)2溶液中含有的离子数目为0.2NA | |
| D. | 28 gN2中所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电池反应过程中,SO42-向带正电荷的正极移动 | |
| B. | 随着反应的进行正极区域附近pH变小 | |
| C. | 当转移4mol电子时,溶液中CH3COOH分子个数为NA | |
| D. | 负极的电极反应方程式为CH2=CH2-4e-+2H2O═CH3COOH+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com