
| A、X有三种同位素 |
| B、其中一种同位素的原子质量数为81 |
| C、质量数为79的同位素,其原子质量分数为50% |
| D、X2的平均相对分子质量为159 |
| 158×7+160×10+162×7 |
| 24 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠的摩尔质量是40g |
| B、1mol NaOH的质量是40g/mol |
| C、1g H2和1g N2所含分子数相等 |
| D、等质量的N2、CH4、CO、H2O中CH4所含分子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (g)?
(g)?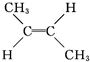 (g)△H=-4.2kJ?mol-1
(g)△H=-4.2kJ?mol-1 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.| A、顺-2-丁烯比反-2-丁烯稳定 |
| B、1 mol反-2-丁烯完全燃烧生成CO2和液态水所放出的热量比顺-2-丁烯的大 |
| C、28 g顺-2-丁烯完全氢化生成丁烷气体时所放出的热量为118.9 kJ |
D、反-2-丁烯氢化的热化学方程式为 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氧化还原反应中,一定是一种元素被氧化,另一种元素被还原 |
| B、在氧化还原反应中,不一定所有元素的化合价都发生改变 |
| C、有单质参加反应或有单质生成的反应一定是氧化还原反应 |
| D、某元素由化合态转化为游离态,这种元素一定被还原了 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮氧化物的大量排放是造成光化学烟雾的主要原因 |
| B、检查病人胃病所用的钡餐,既可以用BaSO4,也可以用BaCO3 |
| C、浓硫酸不可用来干燥NH3,因其具有强氧化性 |
| D、雨水样品放置一段时间后,pH由4.68变为4.28,是因为溶解了较多的氮氧化物和CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com