
| X | |
| Y | Z |
| A. | 若 X 通过共用三对电子可形成 X2 分子,Z 在周期表中的位置是第三周期Ⅵ族 | |
| B. | 若 X、Y、Z 都是金属,则它们的最高价氧化物的水化物都是强碱 | |
| C. | 若它们原子最外层电子数之和为 13,则它们均为非金属元素 | |
| D. | 若 X、Y、Z 都是非金属,则三者形成的简单氢化物中,Z 的氢化物沸点最高 |
分析 A.若 X 通过共用三对电子可形成 X2 分子,则X为N元素,Y为P元素,Z为S元素;
B.X、Y、Z 都是金属,则X为Li、Y为Na、Z为Mg;
C.若它们原子最外层电子数之和为 13,则X为C、Y为Si、Z为P元素;
D.若 X、Y、Z 都是非金属,如X为O,则O对应的氢化物沸点最高.
解答 解:A.若 X 通过共用三对电子可形成 X2 分子,则X为N元素,Y为P元素,Z为S元素,Z 在周期表中的位置是第三周期ⅥA族,而不是Ⅵ族,故A错误;
B.X、Y、Z 都是金属,则X为Li、Y为Na、Z为Mg,只有NaOH为强碱,故B错误;
C.若它们原子最外层电子数之和为 13,则X为C、Y为Si、Z为P元素,均为非金属,故C正确;
D.若 X、Y、Z 都是非金属,如X为O,则O对应的氢化物分子间存在氢键,作用力较强,沸点最高,故D错误.
故选C.
点评 本题考查元素周期表及元素周期律的综合应用,为高考常见题型和高频考点,侧重考查学生的分析能力,通过元素周期表中短周期部分的结构和元素位置推出元素种类,熟悉物质的性质和元素周期律的知识是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯分子中含碳碳双键 | B. | 乙醇、苯和溴苯用水即可鉴别 | ||
| C. | 汽油、柴油、植物油都是碳氢化合物 | D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的有机物有三种,它们互为同系物 | |
| B. | C4H8C12有9种同分异构体(不考虑立体异构) | |
| C. | 石蜡油、苯、四氟乙烯都不能使溴水褪色 | |
| D. | 等物质的量的甲烷与氯气反应后体积保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
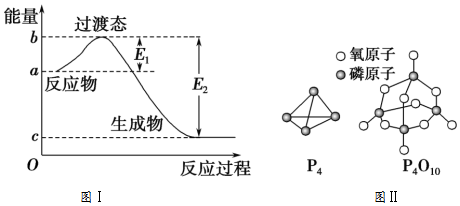
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/(kJ/mol) | a | b | c | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是亲氧元素,在自然界中以化合态存在 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位 | |
| C. | 硅的活泼性比碳强,只有在高温下才能跟氢气起化合反应 | |
| D. | 二氧化硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L的FeCl3溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1 NA | |
| B. | 7.8 gNa2O2中含有的离子总数目为0.4 NA | |
| C. | 标准状况下,44.8 L HF所含分子数为2 NA | |
| D. | 标准状况下,80 gSO3中所含的原子数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
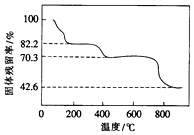 硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.
硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.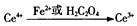
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水清除试管壁附着的银镜 | |
| B. | 用氢氧化钠溶液清洗沾在皮肤上的苯酚 | |
| C. | 用食醋清除暖瓶水垢(主要成分碳酸钙) | |
| D. | 用碳酸钠溶液清除钢铁制品表面的铁锈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com