
【题目】砷(As)在地壳中含量不高,但砷的化合物却是丰富多彩。回答下列问题:
(1)砷的基态原子简化电子排布式为__________________;第一电离能:砷______硒(填“>”或“<”)
(2)目前市售发光二极管材质以砷化镓(CaAs)为主。Ga和As相比,电负性较大的是____________,CaAs中Ga元素的化合价为____________。
(3)AsH3是无色、稍有大蒜味气体。AsH3空间构型为____________。AsH3的沸点高于PH3,低于NH3,其原因是_________________________________。
(4)Na3AsO4可作杀虫剂。 AsO43 中As原子杂化轨道类型为__________。与AsO43互为等电子体 分子和离子各填一种___________、__________。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据物质结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 _____________________________________________________。
(6)磷和砷同主族。磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如图所示。若其晶胞边长为a pm,则白磷的密度为_______________g·cm-3(列出计算式即可)。

![]() 1个 代表一个白磷分子
1个 代表一个白磷分子
【答案】 [Ar]3d104s24p3 > As +3 三角锥形 AsH3的相对分子质量比PH3的大,分子间作用力大,NH3分子间
形成氢键, 因而AsH3的沸点比PH3高,比NH3低 sp3 SO42 CCl4 H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏
移,越易电离出H+ ![]()
【解析】
As是33号元素,其原子核外有33个电子,根据构造原理书写其基态原子核外价电子排布式;同周期电离能第ⅤA族>第ⅥA族,据此分析解答;同周期随原子序数递增电负性增大;根据化合价代数和为0计算;利用价层电子对互斥模型判断分子的空间构型和杂化方式;对于组成和结构相似的物质分子间作用力和其相对分子质量成正比,含有氢键的物质熔沸点异常高;根据价层电子对互斥理论确定杂化类型,价层电子对个数=σ键+孤电子对个数,孤电子对个数=(axb)/2,a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多能接受的电子数;根据等电子体是指具有相同价电子数目和原子数目的分子或离子来回答;非羟基氧越多、As化合价越高则酸性越强;根据均摊法计算晶胞中白磷分子数目,计算晶胞的质量、晶胞的体积,根据ρ=![]() 计算晶胞密度。
计算晶胞密度。
(1)As的原子序数为33,最外层有5个电子,由构造原理可知核外电子排布为[Ar]3d104s24p3;砷在第四周期第ⅤA族,硒在第四周期第ⅥA族,同周期电离能第ⅤA族>第ⅥA族,所以砷大于硒,故第一电离能:As>Se,
故答案为:[Ar]3d104s24p3 ;>;
(2)同周期随原子序数递增电负性增大,Ga和As同周期,As的原子序数较大,故电负性较大的是As;As处于ⅤA族,电负性较大,表现-3价,故Ga为+3价,
故答案为:As; +3 ;
(3)AsH3中含有3个![]() 键和1个孤电子对,为三角锥形;AsH3的相对分子质量比PH3的大,分子间作用力大,NH3分子间形成氢键,因而AsH3的沸点比PH3高,比NH3低;
键和1个孤电子对,为三角锥形;AsH3的相对分子质量比PH3的大,分子间作用力大,NH3分子间形成氢键,因而AsH3的沸点比PH3高,比NH3低;
故答案为:三角锥形 ;AsH3的相对分子质量比PH3的大,分子间作用力大,NH3分子间形成氢键, 因而AsH3的沸点比PH3高,比NH3低;
(4)AsO43-中含有的孤电子对数是0,中心原子有4个共价键,所以其杂化类型为sp3;等电子体是指具有相同价电子数目和原子数目的分子或离子,与AsO43互为等电子体的分子和离子分别为SO42- 、CCl4,
故答案为:sp3 ;SO42-、CCl4;
(5)H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏移,越易电离出H+,
故答案为:H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏移,越易电离出H+。
(6)由晶胞结构可以知道,晶胞中白磷分子数目=8×![]() +6×
+6×![]() =4,则晶胞的质量m=
=4,则晶胞的质量m=![]() g,晶胞边长为apm,则晶胞的体积为V=(a×10-10)3cm3,故晶胞的密度为ρ=
g,晶胞边长为apm,则晶胞的体积为V=(a×10-10)3cm3,故晶胞的密度为ρ=![]() =
= =
=![]() g·cm-3,
g·cm-3,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.SO2具有氧化性,可用于漂白纸浆
B.氨气易液化且汽化时吸收大量的热,可用作制冷剂
C.NH4HCO3受热易分解,可用作氮肥
D.生石灰能与水反应,可用来干燥氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途。
(1)真空碳热还原—氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=_________kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)=___________,T1℃时,该反应的平衡常数K=_______
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________(填字母编号)。
a.通入一定量的NO b.通入一定量的N2
c.适当升高反应体系的温度 d.加入合适的催化剂
e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是_________(填选项编号)。
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=_______ mol/L。NO的转化率_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Kb(NH3·H2O)=1.76×10-5。25℃时,分别向浓度均为0.1mol/L,体积均为20mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c水(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是

A. HX的电离方程式为HX==H++X-
B. b点时溶液中c(NH4+)=c(Y-)>c(H+)=c(OH-)
C. 其中一种酸的电离度为0.1%
D. a点溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取未知浓度的硫酸、盐酸和醋酸各25.00mL,分别用0.10mol/L的NaOH溶液或0.10mol/L的稀氨水滴定得到下图曲线。下列说法正确的是
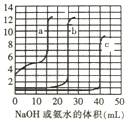
A. 由图可知曲线c为NaOH滴定硫酸
B. 由图可知硫酸的物质的量浓变大于盐酸的物质的量浓度
C. 曲线b、c的滴定实验可用酚酞做指示剂
D. 由图可知滴定前醋酸的物质的量浓度为0.060mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙道常用氢气与纯净的金属钙加热制取,如图是模拟制取装置:
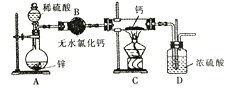
(1)为了确认进入装置C的氢气已经干燥应在B、C之间再接一装置,该装置中加入的试剂是______________。
(2)该实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,接下来的操作顺序是_______(填序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)某同学取一定质量的产物样品(m1g),加入过量碳酸钠溶液,过滤、洗涤、干燥后称量固体碳酸钙质量(m2g),计算得到样品中氢化钙的质量分数为101.14%。若该同学所有操作均正确,则产生这种情况的原因可能是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com