
| A、①>②>③>④ |
| B、①>④>③>② |
| C、②>①>③>④ |
| D、②>③>④>① |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
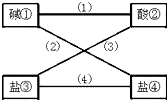 从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)八种物质中选出四种,使得各线条相连的物质均能发生反应且生成难溶物.
从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)八种物质中选出四种,使得各线条相连的物质均能发生反应且生成难溶物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸、水煤气、醋酸、干冰 |
| B、硝酸、酒精、苛性钠、氨气 |
| C、冰醋酸、福尔马林、硫酸钠、乙醇 |
| D、胆矾、漂白粉、氯化钾、氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤⑥ | B、①②⑤⑥ |
| C、①②④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
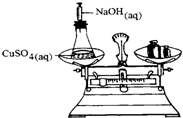 将一密闭的化学反应装置在天平上称量(如图所示).当在溶液中注入氢氧化钠溶液之后,下列叙述正确的是( )
将一密闭的化学反应装置在天平上称量(如图所示).当在溶液中注入氢氧化钠溶液之后,下列叙述正确的是( )| A、会有沉淀产生,天平左盘质量增加 |
| B、有气体产生,天平左盘质量减少 |
| C、此实验可用于说明化学反应的质量守恒 |
| D、本反应的离子方程式为:CuSO4+2OH-═Cu(OH)2↓+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所得溶液中的c(H+)=1.0×10-13mol?L-1 |
| B、所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol?L-1 |
| C、所得溶液中的c(Mg2+)=5.6×10-10 mol?L-1 |
| D、298K时,饱和Mg(OH)2的溶液与饱和MgF2溶液相比前者的c(Mg2+)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com