

| N-N | N═N | N≡N | N-H | H-H |
| 193 KJ/mol | 418KJ/mol | 946KJ/mol | 391KJ/mol | 436KJ/mol |
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:分析 I、反应热△H=反应物的总键能-生成物的总键能;
II、(1)根据图象1可知,曲线C为氢气的浓度的变化曲线,根据v(H2)=$\frac{△c({H}_{2})}{△t}$来计算;平衡常数K=$\frac{生成物平衡浓度幂之积}{反应物平衡浓度幂之积}$;
(2)当一个量在反应未达平衡时在变,而后来不变了,则此量可以作为平衡的标志;
(3)当容器恒压时,相当于是在恒容达平衡的基础上再压缩容器的体积,平衡右移,氮气的物质的量变小,但浓度比原来大;
(4)①根据化学键的断裂要吸收能量,且反应放热来分析;
②c0前氨的浓度增加,导致反应速率加快;c0后由于氨分子浓度太大阻碍N2和H2的解吸.
解答 解:I、由于反应热△H=反应物的总键能-生成物的总键能,则N2(g)+3H2(g)?2NH3(g)△H=(946KJ/mol)+3×(436KJ/mol)-6×(391KJ/mol)=-92kJ/mol,故答案为:-92kJ/mol;
II、(1)根据图象1可知,曲线C为氢气的浓度的变化曲线,△c(H2)=1.5mol/L,故v(H2)=$\frac{△c({H}_{2})}{△t}$=$\frac{1.5mol/L}{2s}$=0.75mol/(L.s);平衡常数K=$\frac{生成物平衡浓度幂之积}{反应物平衡浓度幂之积}$=$\frac{(1.00mol/L)^{2}}{(1.5mol/L)^{3}•(1.00mol/L)}$,故答案为:0.75mol/(L.s),$\frac{(1.00mol/L)^{2}}{(1.5mol/L)^{3}•(1.00mol/L)}$;
(2)A.此反应中的反应物和生成物全为气体,故气体的质量一直不变,而反应向正反应方向进行时,气体的物质的量减小,故在平衡之前,混合气体的平均相对分子质量在减小,故当不变时,说明反应达平衡,故A正确;
B.无论反应是否达到平衡,物质的物质的量浓度比和系数比之间无必然的联系,即反应达平衡后,浓度之比不一定等于系数之比,当浓度等于系数之比时,反应不一定达平衡,故B错误;
C.此容器为恒温的容器,容器内的温度一直不变,故容器内温度不变时,不能说明反应达平衡,故C错误;
D.断裂1moIH-H键意味着有1mol氢气被消耗,同时断裂2molN-H键,意味着有1mol氢气生成,则氢气的消耗量和生成量相同,则反应达平衡,故D正确;
故选AD.
(3)当容器恒压时,相当于是在恒容达平衡的基础上再压缩容器的体积,平衡右移,氮气被消耗,则氮气的物质的量变小,但浓度比恒容时要变大,故答案为:增大;
(4)①由于化学键的断裂要吸收能量,故活化状态B的能量高于初始状态A的能量,而此反应为放热反应,故初始状态A的能量高于末态C的能量,故C的能量最低,故答案为:C;
②c0前氨的浓度增加,导致反应速率加快;c0后由于氨分子浓度太大阻碍N2和H2的解吸,故反应速率减慢,故答案为:氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸.
点评 本题考查了反应热的计算、反应达平衡的判断和平衡常数的计算等内容,正确解读题目给出的信息是解决信息性题目的关键,要善于从信息中捕捉最有效的信息用来处理问题.


科目:高中化学 来源: 题型:选择题

| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与N连接,正极反应式是4OH--4e-═2H2O+O2↑ | |
| C. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| D. | 若电键K与M连接,当两极共产生22.4L(标准状况)气体时,生成了1mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
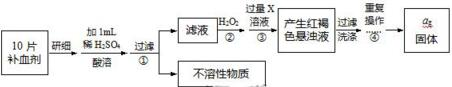
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气、明矾净水原理相同 | |
| B. | 过氧化钠、活性炭均可用于呼吸面具 | |
| C. | 硅胶和铁粉均可用于食品的防氧化 | |
| D. | 甲烷的氯代物均可作防火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
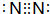 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 酸性氧化物 | 能导电 | 电解质 |
| 属于该类的物质 | ③④ | ②⑦⑧⑨ | ⑤⑥⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.
非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com