
| c4(H2O) |
| c4(H2) |
| ||
| 4 |
| ||
| 2min |
| 2xg+18yg |
| (x+y)mol |
| 3 |
| 1 |


科目:高中化学 来源: 题型:
| A、2,5-二甲基-3-乙基己烷的实验式:C5H11 |
B、芳香烃M的结构模型为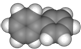 ,则M的结构简式为 ,则M的结构简式为  |
| C、纤维素三硝酸酯的分子式为(C6H7N3O11)n |
D、有机物 中所有原子有可能都在同一平面上 中所有原子有可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、萃取 |
| D、蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焚烧 |
| B、粉碎后深埋 |
| C、倾倒在海洋中 |
| D、用化学方法加工成防水涂料或汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.
如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体且1mol E中含有 10mol电子.乙和丁为黑色固体,将它们混和加热后发现固体由黑色变为红色
如图是常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体且1mol E中含有 10mol电子.乙和丁为黑色固体,将它们混和加热后发现固体由黑色变为红色查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时间/小时 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com