
(本题共12分)氰酸(化学式:HOCN)是一种有挥发性和腐蚀性的液体,在水中立刻发生如下反应形成盐X(俗名碳铵):HOCN + 2H2O → X。
23.在上述反应所涉及的各元素中,半径最大的元素原子核外电子共占据_______个轨道。
24.能说明氮元素的非金属性比碳元素强的事实是_________(选填编号)。
A.共用电子对偏向:H-N>H-C B.氧化性:NO2>CO2
C.酸性:HNO3>H2CO3 D.沸点:NH3>CH4
25.据测定,氰酸有两种结构,一种分子内含有叁键,称为正氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出正氰酸和异氰酸的结构式:_______________、______________。
26.下面是工业上冶炼Cr时会涉及到的反应:
CrO42-+ S+ H2O → Cr(OH)3↓+ S2O32-+
(1)请将方程式补充完整并配平。
(2)上述反应中,若转移了3mol电子,得到的还原产物是 mol。
27.铁和镍(Ni)位于周期表的同一周期同一族,铁和镍在 周期 族。
28.镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150℃时,Ni(CO)4分解为Ni和CO。Ni(CO)4是 晶体,Ni(CO)4易溶于下列 (填序号)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
23.4 (1分) ;24.A、C(2分) 25.H-O-C≡N;H-N=C=O(2分)
26.(1)4CrO42-+6 S+7 H2O →4 Cr(OH)3↓+3S2O32-+2OH-(2分,物质、配平各1分)(2)1(1分)
27.第四,第Ⅷ(1分,都对给分) 28.分子晶体(1分) B、C(2分,各1分)
【解析】
试题分析:23. 在上述反应所涉及的元素有H、O、C、N。同一周期的元素,原子序数越大,原子半径就越小;不同周期的元素,原子核外电子层数越多,原子半径就越大。故这几种元素的原子半径大到小顺序是:C>N>O>H,半径最大的元素C的原子核外电子排布式是1s22s22p2,共占据4个轨道;
24. A. C、N是同一周期的元素,原子半径N<C,吸引电子的能力N>C,共用电子对偏向:H-N>H-C所以能说明氮元素的非金属性比碳元素强,正确;B.比较元素的非金属性的强弱,应该看元素最高价氧化物对应的水化物的酸性强弱,而不能看氧化物的氧化性的强弱,错误;C. 元素最高价氧化物对应的水化物的酸性:HNO3>H2CO3 ,所以元素的非金属性:N>C,正确;D. NH3和CH4都是由分子构成的物质,分子之间的吸引力越强,物质的熔沸点就越高,由于在NH3的分子之间除存在分子间作用力外,还存在氢键,增加了分子的吸引力,使沸点:NH3>CH4,但是这与元素的非金属性的强弱无关,错误;
25. 根据题意可得正氰酸和异氰酸的结构式分别是:H-O-C≡N;H-N=C=O;
26.(1)根据电子守恒、电荷守恒及原子守恒可得方程式:4CrO42-+6S+7 H2O →4Cr(OH)3↓+3S2O32-+2OH-;(2)上述反应中,转移12mol的电子,产生还原产物Cr(OH)3的物质的量是4mol,因此若转移了3mol电子,得到的还原产物是1mol。
27.铁和镍(Ni)的原子序数分别是26、28,位于周期表的同一周期同一族,铁和镍在第四周期第Ⅷ族;
28. Ni(CO)4在室温下呈液态,说明熔沸点较低,而且在150℃时就发生分解反应,说明该物质在固体时是分子晶体;由于Ni(CO)4呈四面体构型,说明该分子是非极性分子。根据相似相容原理可知该物质容易溶于有非极性分子构成的物质四氯化碳、苯中,而不容易溶于有极性分子构成的物质水及含有离子化合物硫酸镍溶液中,故选项是B、C。
考点:考查原子核外电子的排布、元素原子半径的比较、元素非金属性强弱的比较、物质的结构式的书写、离子方程式的配平及氧化还原反应的有关计算、元素在周期表中的位置及物质的晶体类型的判断、物质的溶解性的知识。


科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第三次月考化学试卷(解析版) 题型:选择题
有下列四组物质,如果把某组物质中的后者逐滴加人到前者中至过量,将出现“先产生白色沉淀,后白色沉淀溶解”的现象,这组物质是
A.稀硫酸、氯化钡溶液 B.硫酸铝溶液、氨水
C.氯化钠溶液、硝酸银溶液 D.氯化铝溶液、氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省等四校高一上学期期中联考化学试卷(解析版) 题型:选择题
在无土裁培中,配制1L内含0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4的某营养液,若用KCl、NH4Cl和(NH4)2SO4三种固体配制,则需此三种固体的物质的量分别为
A.0.64mol 0.02mol 0.24mol B.0.66mol 0.50mol 0.24mol
C.0.64mol 0.50mol 0.24mol D.0.40mol 0.50mol 0.12mol
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省等四校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列描述,其因果关系成立的是
A.因为NH3的水溶液可以导电,所以NH3是电解质
B.因为Cl2可以使湿润的有色布条褪色,所以Cl2具有漂白性
C.因为液态HCl不导电,所以HCl是非电解质
D.因为氢氧化铁胶体具有吸附性,所以常用于净水
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:填空题
(本题共12分)现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上有四个取代基且苯环上的一溴代物只有一种,其在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。
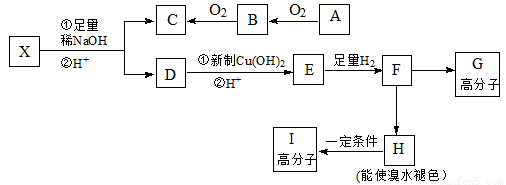
已知:① 在稀碱溶液中,溴苯难发生水解
② 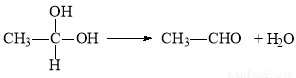
请完成下列填空:
47.X中官能团的名称是 。48.F→H的反应类型是 。
49.I的结构简式为 ;
50.E不具有的化学性质 (选填序号)
A.取代反应 B.消去反应
C.氧化反应 D.1molE最多能与2molNaHCO3反应
51. X与足量稀NaOH溶液共热的化学方程式: ;
52.F→G的化学方程式: ;
53.写出一种同时符合下列条件的E的同分异构体的结构简式 。
A.苯环上有两种不同环境的氢原子 B.不能发生水解反应
C.遇FeCl3溶液不显色 D.1molE最多能分别与1molNaOH和2molNa反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
现有下列短周期元素性质的数据:
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
下列说法正确的是
A.原子序数④元素大⑦元素
B.②、③处于同一周期
C.上述八种元素最高价氧化物对应的水化物,⑤号酸性最强
D.⑧号元素原子结构示意图为: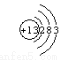
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.3mol NF3与水完全反应生成HF、HNO3和NO,转移电子数2NA
B.22.4L CO2与过量的Na2O2反应,转移的电子数为NA
C.60 g SiO2晶体中含有2 NA个Si-O键
D.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三12月月考理综化学试卷(解析版) 题型:选择题
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g) 4C (s)+D(g),△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。
4C (s)+D(g),△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。

下列说法正确的是
A.平衡时B的转化率为50%
B.若再加入B,则再次达到平衡时正、逆反应速率均增大
C.若保持压强一定,再加入B,则反应体系气体密度减小
D.若保持压强一定,当温度升高10℃后,则图中θ>45?
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:选择题
已知:2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1 的叙述错误的是
A.该反应的反应热为ΔH=-5 800 kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2 和液态水时放出热量5 800 kJ
D.该反应为丁烷燃烧的热化学方程式,则丁烷的燃烧热为5800 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com