
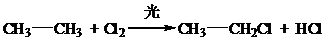 、取代反应
、取代反应 、取代反应.
、取代反应. 分析 (1)乙烷与Cl2在光照条件下1:1反应发生取代反应生成一氯乙烷和氯化氢;
(2)3-甲基-1-丁炔与溴的四氯化碳溶液按物质的量为1:1发生加成反应;
(3)甲苯在浓硫酸作用下与浓硝酸发生取代反应生成三硝基甲苯.
解答 解:(1)乙烷与Cl2在光照条件下1:1反应发生取代反应生成一氯乙烷和氯化氢,化学方程式: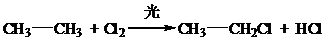 ,反应类型为:取代反应;
,反应类型为:取代反应;
故答案为: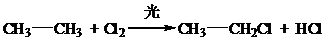 ;取代反应;
;取代反应;
(2)3-甲基-1-丁炔与溴的四氯化碳溶液按物质的量为1:1反应发生加成反应,反应方程式为:CH≡C-CH(CH3)-CH3+Br2→CHBr=CBr-CH(CH3)-CH3,反应类型:加成反应;
故答案为:CH≡C-CH(CH3)-CH3+Br2→CHBr=CBr-CH(CH3)-CH3;加成反应;
(3)甲苯与浓硝酸发生取代反应可生成TNT,即三硝基甲苯,反应的化学方程式为 ,反应类型为取代反应;
,反应类型为取代反应;
故答案为: ;取代反应.
;取代反应.
点评 本题考查有机化学反应方程式书写,把握有机物的结构与性质、官能团与性质的关系为解答的关键,注意有机反应类型及反应条件,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 通入溴水溶液使溴水褪色 | B. | 通入品红溶液中,使品红褪色 | ||
| C. | 溶于水形成不稳定的亚硫酸 | D. | 与碱液反应生成亚硫酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
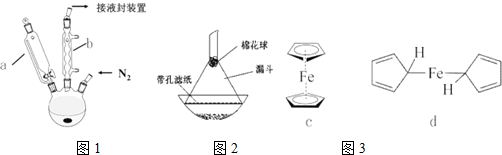
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
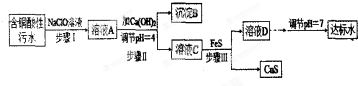
| l离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相同的微粒,它们的化学性质基本相同 | |
| B. | 任何原子的原子核都是由质子和中子构成 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的长式元素周期表中,最长的周期含36种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、O3互为同位素 | |
| B. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| C. | 正丁烷和异丁烷互为同素异形体 | |
| D. | 金刚石、C60互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+2Cl2(g)=4HCl(g)△H=-369、2kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com