
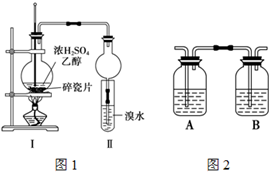
 某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.| 浓H2SO4 |
| 170℃ |
| 浓H2SO4 |
| 170℃ |
| ||


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
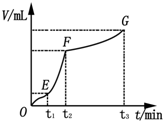 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol?L-1 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中无明显气泡产生; 试管B中产生的气泡量增加 |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和 5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图装置可验证同主族元素非金属性的变化规律
利用如图装置可验证同主族元素非金属性的变化规律| 题号 | 实 验 要 求 | 答案 |
| ① | 从碘水中提取碘单质 | |
| ② | 提纯混有少混NaCl的KNO3 | |
| ③ | 鉴别NaCl和KCl | |
| ④ | 检验自来水中残余氯分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验变量实验序号 | 银氨溶液 的量/ml | 乙醛的量 /滴 | 水浴温度 /℃ | 反应混合 液的PH | 出现银镜的 时间/min |
| 1 | 2 | 3 | 50 | 11 | T1 |
| 2 | 2 | 3 | 65 | 11 | T2 |
| 3 | 2 | 5 | 65 | 11 | T3 |
| 4 | 2 | 5 | 65 | 4 | 无银镜 |
| 5 | 2 | 5 | 65 | 10 | T4 |
| 6 | 4 | 3 | 50 | 10 | T5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5molAl与足量盐酸反应转移电子数为1NA |
| B、标准状况下,11.2L SO3所含的分子数为0.5NA |
| C、0.1 mol CH4所含的电子数为1 NA |
| D、46 g NO2和N2O4的混合物含有的分子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取 NaOH固体20.0 g |
| B、将用水润湿的pH试纸,浸入稀盐酸溶液,测定溶液的pH |
| C、滴定管的0刻度线在上部,而量筒的0刻度线在下部 |
| D、在配制一定物质的量浓度的溶液时,定容后,经摇匀后发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度持平 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com