
A. 用渗析法除去淀粉中的氯化钠
B. 用萃取法分离出碘水中的碘
C. 用点燃的方法除去CO2中少量的CO
D. 除去N2中少量的O2,可将气体通过灼热的铜丝
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:阅读理解
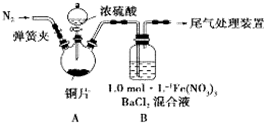 我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.
我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.查看答案和解析>>
科目:高中化学 来源: 题型:013
下列操作方法不可行的是…………………………………………………………………( )
A. 用渗析法除去淀粉中的氯化钠
B. 用萃取法分离出碘水中的碘
C. 用点燃的方法除去CO2中少量的CO
D. 除去N2中少量的O2,可将气体通过灼热的铜丝
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省六校研究会高三联考(1月)理综化学试卷(解析版) 题型:实验题
安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究。
探究I
(1)某同学进行了下列实验:取12.8g铜片和20 mL 18 mol?L-1的浓硫酸放在三颈瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。

①配制1mol/L 的Fe(NO3)3溶液,需准确称量一定质量的Fe(NO3)3固体,在烧杯中溶解恢复到室温后,将溶液转移到容量瓶中,再经过洗涤、定容、摇匀可配得溶液,请回答将溶液转移至容量瓶中的操作方法________________________________。
②装置A中反应的化学方程式是_________________________________________。
③该同学设计求余酸的物质的量实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称重
B.将产生的气体缓缓通入足量Na2S溶液后,测量所得沉淀的质量
C.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)
探究II
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是____________________。
(3)装置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1: SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO3-反应;
猜想3:____________________________________;
①按猜想1,装置B中反应的离子方程式是______________________________,证明该猜想1中生成的还原产物,某同学取少量溶液滴加几滴酸性高锰酸钾溶液,紫红色褪去,请分析该同学做法是否正确_________(填“正确”或“不正确”),理由是__________________________________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
A.1 mol/L 稀硝酸
B.pH=1的FeCl3溶液?
C.6.0mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市六校高三第二次联考化学试卷(解析版) 题型:填空题
2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
|
|
亚硝酸钠(NaNO2) |
氯化钠(NaCl) |
|
水溶性 |
易溶,溶液呈弱碱性 |
易溶,溶液呈中性 |
|
熔点 |
271℃ |
801℃ |
|
沸点 |
320℃会分解 |
1413℃ |
|
跟稀盐酸作用 |
有红棕色的NO2气体放出 |
无反应 |
完成下列填空:
(1)氮元素最外层电子排布式为________,氮原子核外电子共占据了___个轨道。亚硝酸钠中各元素原子半径由大到小依次为_________,亚硝酸的电离方程式为:_______________________。
(2)亚硝酸盐中毒是因为亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,即血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.美蓝是亚硝酸盐中毒后的有效解毒剂.下列说法不正确的是( )
A.高铁血红蛋白的还原性比亚硝酸盐弱
B.药品美蓝应具有还原性
C.中毒时亚硝酸盐发生还原反应
D.解毒时高铁血红蛋白被还原
(3)NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须处理后才能排放。处理方法之一:在酸性条件下, NaNO2与KI的物质的量为1:1时恰好完全反应,且I-被氧化为I2,此时产物中含氮的物质(A)为________(填化学式)。若利用上述方法制A,现有两种操作步骤:①先将废水酸化后再加KI;②先将KI酸化后再加入废水。哪种方法较好?____(填序号。假设废水中其它物质不反应)
(4)如要鉴别亚硝酸钠和氯化钠固体,下列方法不可行的是
A.观察并比较它们在水中的溶解速度 B.测定它们各自的熔点
C.在它们的水溶液中滴加甲基橙 D.在酸性条件下加入KI淀粉试液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com