
| 离子 | Na+ | Cl- | NO2- | Mg2+ |
| 浓度(mol/L) | 0.05 | 0.06 | 0.015 |


科目:高中化学 来源: 题型:
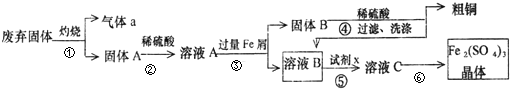
查看答案和解析>>
科目:高中化学 来源: 题型:
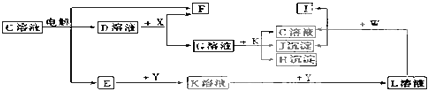
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、青霉素等抗生素对病原体有抑制和杀灭作用,但在使用之前要进行过敏性实验 |
| B、吗啡、海洛因等虽然有麻醉、止痛、镇静作用,但易上瘾且有害,这类物质属于毒品 |
| C、麻黄碱是国际奥委会严格禁止使用的兴奋剂 |
| D、R表示非处方药,OTC表示处方药 |
查看答案和解析>>
科目:高中化学 来源: 题型:
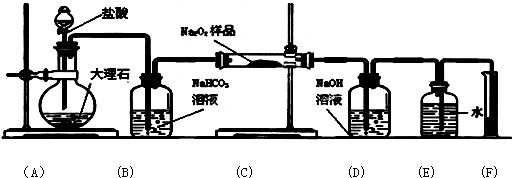
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降温 |
| B、加入CaSO4 |
| C、加入BaCl2 |
| D、加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | SO42-、Fe2+、NO3-、K+ | K3[Fe(CN)6] | 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ |
| B | Na+、Fe3+、I-、ClO- | H2SO4 | ClO-+H+=HClO |
| C | Ba2+、HCO3-、Cl-、H+ | Na2SO4 | Ba2++SO42-=BaSO4 |
| D | Al3+、Cl-、NO3-、K+ | 过量NaOH | Al3++3OH-=Al(OH)3↓ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢管与电源正极连接,钢管可被保护 |
| B、铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 |
| C、钢管与铜管露天堆放在一起时,钢管不易被腐蚀 |
| D、钢铁发生析氢腐蚀时,负极反应是2H++2e-═H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com