
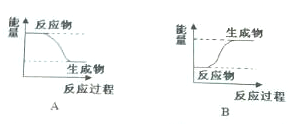
分析 (1)根据反应物的总能量为E1和生成物的总能量为E2的相对大小判断;
(2)反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量之和的相对大小判断反应的吸放热,二者的差值即为焓变的数值;
(3)酸碱中和反应和活泼金属与酸的反应都是放热反应;要构成原电池必须能自发的氧化还原反应.
解答 解:(1)若反应物的总能量为E1大于生成物的总能量为E2,则为放热反应,故答案为:放热;A;
(2)反应方程式为:H2+Cl2=2HCl,生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,放出能量:2×431kJ=862kJ,放出的能量大于吸收的能量,则该反应放热,焓变为负号,且放出的热量为:862kJ-679kJ=183kJ,所以△H=-183KJ/mol.
故答案为:-183KJ/mol;
(3)酸碱中和反应和活泼金属与酸的反应都是放热反应,所以①②都是放热反应;要构成原电池必须能自发的氧化还原反应,NaOH+HCl=NaCl+H2O是非氧化还原反应,而Fe+H2SO4=FeSO4+H2↑是氧化还原反应,故答案为:①②;②.
点评 本题考查反应中的能量变化的原因、反应热的计算以及原电池原理,题目难度不大.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
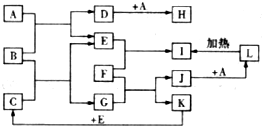 如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.
如图所示,各物质间存在如下相互转化关系,其中B为淡黄色固体.F为金属单质,能和氧化铁反应,生成铁单质.E和K为无色气体单质,其它物质均为化合物,A为无色气体,C为无色液体.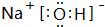 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水5mL,反应温度10℃ | |
| B. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度10℃ | |
| C. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ | |
| D. | 0.2 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取a克混合物与足量浓盐酸充分反应,通过排饱和NaHCO3溶液测得生成气体b升(标准状况) | |
| B. | 取a克混合物与足量硝酸银溶液充分反应,过滤、洗涤、烘干,得b克固体 | |
| C. | 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 | |
| D. | 取a克混合物与足量Ba(OH)2溶液充分反应,过滤,称量得b克固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子的立体结构为正四面体 | B. | 碳原子以sp3杂化 | ||
| C. | 属于极性分子 | D. | 有手性异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶 | |
| B. | 用加热法可以分离KMnO4和碘单质的混合物 | |
| C. | 经氯气消毒的自来水,若用于配制Na2CO3溶液和FeSO4溶液均会使所配溶液变质 | |
| D. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳-12原子:${\;}_{12}^{6}$C | B. | 硫离子结构示意图: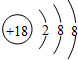 | ||
| C. | 氢氧根的电子式: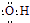 | D. | HClO的结构式:H-O-Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com