
【题目】复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是( )
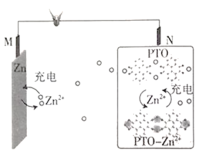
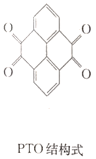
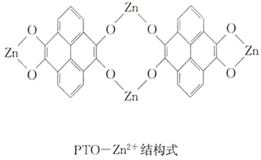
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.充电时,N极的电极反应式为2PTO+8e-+4Zn2+==PTO-Zn2+
D.放电时,每生成1molPTO-Zn2+,M极溶解![]() 的质量为260g
的质量为260g
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、ⅤA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的核外电子有__种不同的空间运动状态。
(2)P、S、Cl的第一电离能由大到小的顺序为__。
(3)M与Ga位于同周期,M3+的一种配合物组成为[M(NH3)5(H2O)]Cl3。
①下列有关NH3、H2O的说法正确的是__(填字母)。
a.分子空间构型相同
b.中心原子杂化类型相同
c.键角大小相同
②1mol[M(NH3)5(H2O)]3+含__个σ键。
③配合物T与[M(NH3)5(H2O)]Cl3组成元素的种类和数目相同,中心离子的配位数相同。1molT溶于水,加入足量AgNO3溶液可生成2molAgCl。则T的化学式为___。
(4)如图甲为硼酸晶体的片层结构,其中硼的杂化方式为__。H3BO3在热水中比冷水中溶解度显著增大的主要原因是__。
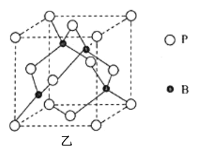
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图乙所示,该晶胞中B原子相连构成几何体的空间构型为__(填“立方体”或“正四面体”或“正八面体”)。已知该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为__pm(列式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的热化学方程式为___________________________,
表示该反应中和热的离子方程式为_________________________________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式__________________________________。
(3)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1 648 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393 kJ/mol
2Fe(s)+2C(s)+3O2(g)===2FeCO3(s) ΔH=-1 480 kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
_________________________________________________________________。
(4)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为______________________________________________。
(5)已知反应2HI(g)===H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为________________kJ。
(6)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。
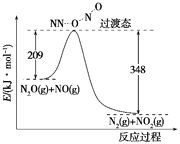
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OCH3(二甲醚)常用作有机合成的原料,也用作溶剂和麻醉剂。CO2与H2合成CH3OCH3涉及的相关热化学方程式如下:
Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
Ⅱ.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g) ΔH3
CO(g)+H2(g) ΔH3
Ⅳ.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH4
CH3OCH3(g)+3H2O(g) ΔH4
回答下列问题:
⑴ΔH4=__kJ·mol-1。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行。反应Ⅰ、Ⅱ、Ⅲ的自由能变与温度的关系如图a所示,在298~998K下均能自发进行的反应为__(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
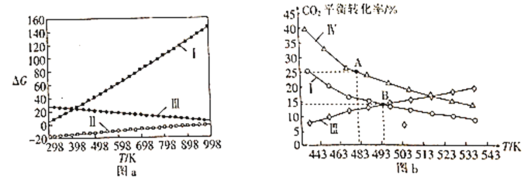
⑶在三个完全相同的恒容密闭容器中,起始时均通入3molH2和1molCO2,分别只发生反应Ⅰ、Ⅲ、Ⅳ时,CO2的平衡转化率与温度的关系如图b所示。
①ΔH3__0(填“>”或“<”)。
②反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为p(CO2)__pMPa(精确到0.01)。
③在B点对应温度下, K(Ⅰ)__(填“大于”“小于”或“等于”)K(Ⅲ)。
⑷向一体积为1L的密闭容器中通入H2和CO2,只发生反应Ⅳ。CO2的平衡转化率与压强、温度及氢碳比m[m=![]() ]的关系分别如图c和图d所示。
]的关系分别如图c和图d所示。
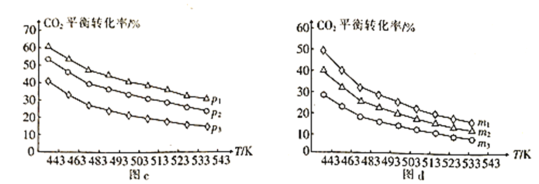
①图c中压强从大到小的顺序为__,图d中氢碳比m从大到小的顺序为__。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%,则在此温度下该反应的平衡常数K=__(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物类别关系图如图所示:

在下列六种有机物中
① ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]()
(1)属于芳香族化合物的是__;
(2)属于芳香烃的是__;
(3)属于苯的同系物的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g) + B2(g)=2AB(g) 的能量变化如图所示,下列叙述中正确的是( )
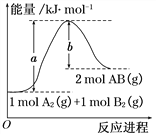
A.每生成2mol AB(g) 共吸收b kJ热量
B.该反应热ΔH = +(a-b) kJ·mol-1
C.反应物的总能量大于生成物的总能量
D.断裂1 mol A—A键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学习小组的同学设计实验,制备(NH4)2Fe(SO4)26H2O并探究其分解规律。实验步骤如下:
Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。
Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。
Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。
Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)26H2O。
V.将(NH4)2Fe(SO4)26H2O脱水得(NH4)2Fe(SO4)2,并进行热分解实验。
已知在不同温度下FeSO47H2O的溶解度如表:
温度(℃) | 1 | 10 | 30 | 50 |
溶解度(g) | 14.0 | 17.0 | 25.0 | 33.0 |
回答下列问题:
(1)步骤Ⅰ用热的Na2CO3溶液洗涤工业废铁粉的目的是__,步骤Ⅱ中设计铁粉过量,是为了__,加热反应过程中需不断补充蒸馏水的目的是__。
(2)步骤Ⅲ中称量反应后剩余铁粉的质量,是为了__。
(3)(NH4)2Fe(SO4)2分解的气态产物可能有N2、NH3、SO2、SO3及水蒸气,用下列装置检验部分产物。

①检验气态产物中的SO2和SO3时,装置连接顺序依次为__(气流从左至右);C中盛放的试剂为__。
②装置A的作用是__。
③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用某种粗盐进行提纯实验,步骤如下图所示。

请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是__________________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ________ | 猜想Ⅰ 成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | ________ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,________ | ________ | 猜想Ⅲ 成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com