
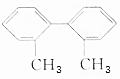
 ,请完成下列空白:
,请完成下列空白:分析 (1)由结构简式可知有机物分子式;
(2)由结构简式可知,分子中含2个苯环,苯环为平面结构,直接与苯环相连的原子与苯环在同一平面内,结合对称性分析;
(3)根据苯环上含有的等效氢原子数目进行判断其一氯代物种类.
解答 解:(1)有机物A的分子式是C14H14;
故答案为:C14H14;
(2)甲基与苯环平面结构通过单键相连,甲基的C原子处于苯的H原子位置,所以处于苯环这个平面;
两个苯环相连,与苯环相连的碳原子处于该苯环中的H原子位置,也处于另一个苯环这个平面,另一苯环所用的C原子都处于同一平面上,处于苯环对位上的碳原子以及碳原子所连的氢原子共线,所以至少有9个碳原子共面,至多有14个碳原子共面;
故答案为:9;14;
(3)有机物A的苯环上的一氯代物有4种: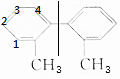 ,故答案为:4.
,故答案为:4.
点评 本题考查有机物的结构与性质,把握结构中共面问题及苯的结构为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸型酸雨的形成涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 常温下,0.1mol/L醋酸溶液pH≈3:CH3COOH?CH3COO-+H+ | |
| D. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 标准状况下,22.4L 甲醇中含有的氧原子数为1NA | |
| C. | 1mol羟基中电子数为10NA | |
| D. | 在30 g甲醛和醋酸的混合物中,含有碳原子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
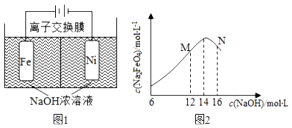
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
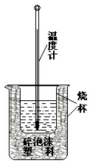 50ml 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
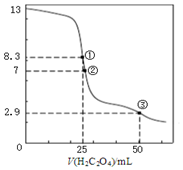 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:c(H+)+2c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=0.0500mol•L-1 | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
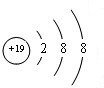
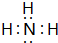 ;⑨的最高价氧化物对应的水化物
;⑨的最高价氧化物对应的水化物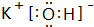 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 | |
| C. | 醋酸钠溶液呈一定的碱性 | |
| D. | 0.1mol/L的CH3COOH溶液中,氢离子浓度约为0.001mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com